2021 was het tweede jaar dat grotendeels in het teken stond van de coronapandemie. Door hard werken en een intensieve Europese samenwerking zijn er meerdere coronavaccins en -medicijnen beoordeeld op werkzaamheid, kwaliteit en veiligheid.
Veel procedures
In Europa waren er eind 2021 vijf coronavaccins beschikbaar met een (voorwaardelijke) handelsvergunning. Ook zijn er vier medicijnen die elk op hun eigen manier ingezet kunnen worden voor de behandeling van COVID-19. Voor twee medicijnen, die al voor een andere indicatie geregistreerd zijn, hebben de fabrikanten gegevens ingestuurd voor de behandeling van COVID-19. Al deze medicijnen en vaccins zijn grotendeels in 2021 beoordeeld. Maar ook na markttoelating wordt de veiligheid goed in de gaten gehouden. Van het verzamelen en analyseren van meldingen van vermoedelijke bijwerkingen, het in kaart brengen van mogelijke risico’s, tot het doornemen van nieuwe gegevens, zoals wetenschappelijke literatuur en (vervolg)onderzoeken die de fabrikant aanlevert.
De (voorwaardelijke) handelsvergunningen voor de coronavaccins, waarbij Nederland in een aantal gevallen ook als (co-)rapporteur betrokken was, brachten op verschillende manieren veel werk met zich mee. Vaccins en medicijnen werden beoordeeld in een versnelde beoordelingsprocedure, de zogeheten rolling review. Hierbij deelt een bedrijf al informatie met de medicijnautoriteit, terwijl het klinisch onderzoek nog in volle gang is. Zo kan de beoordeling eerder starten en dit levert een aanzienlijke tijdswinst op. Dit is een intensieve manier van werken met zeer korte deadlines, die op deze manier niet houdbaar is voor de langere termijn. De procedures hebben veel inzet gevraagd van de beoordelaars en de Regulatory Project Leaders van het CBG.
Daarnaast zijn er ook talloze variaties op de handelsvergunningen ingediend en beoordeeld. In de loop van het jaar zijn bijvoorbeeld de indicaties uitgebreid voor Comirnaty en Spikevax, de coronavaccins van BioNTech/Pfizer en Moderna, voor kinderen en jongeren vanaf 12 (Comirnaty en Spikevax) en later 5 jaar (Comirnaty). Ook het coronamedicijn Veklury (remdesivir) kreeg een bredere indicatie.
Ook op het gebied van geneesmiddelenbewaking is er in 2021 extra inzet geweest. Als PRAC Rapporteur voor Comirnaty heeft Nederland een voortrekkersrol binnen Europa op het gebied van signaaldetectie en beoordeling van protocollen en resultaten van post-marketing studies. Er is intensief samengewerkt met het RIVM en Bijwerkingencentrum Lareb en in Europa. Maandelijks zijn rapportages van meldingen van vermoedelijke bijwerkingen van COVID-19 vaccins beoordeeld, van zowel Lareb als uit de veiligheidsrapportages van de firma's.
Procedures waarbij Nederland de rol van (co-)rapporteur had, leverden een aanzienlijke hoeveelheid werk op. Hetzelfde gold zeker ook voor de procedures waarbij Nederland als ‘concerned member state’ betrokken was.
Ondanks de grote hoeveelheid procedures en de korte deadlines heeft het CBG meer ervaring opgedaan met afstemming met het College buiten de Collegevergaderingen om. Ook wordt veelvuldig gebruikt gemaakt van de expertise van Collegeleden buiten vergadermomenten om. De besluitvorming is dankzij de inbreng van Collegeleden op een hoog niveau gebleven.
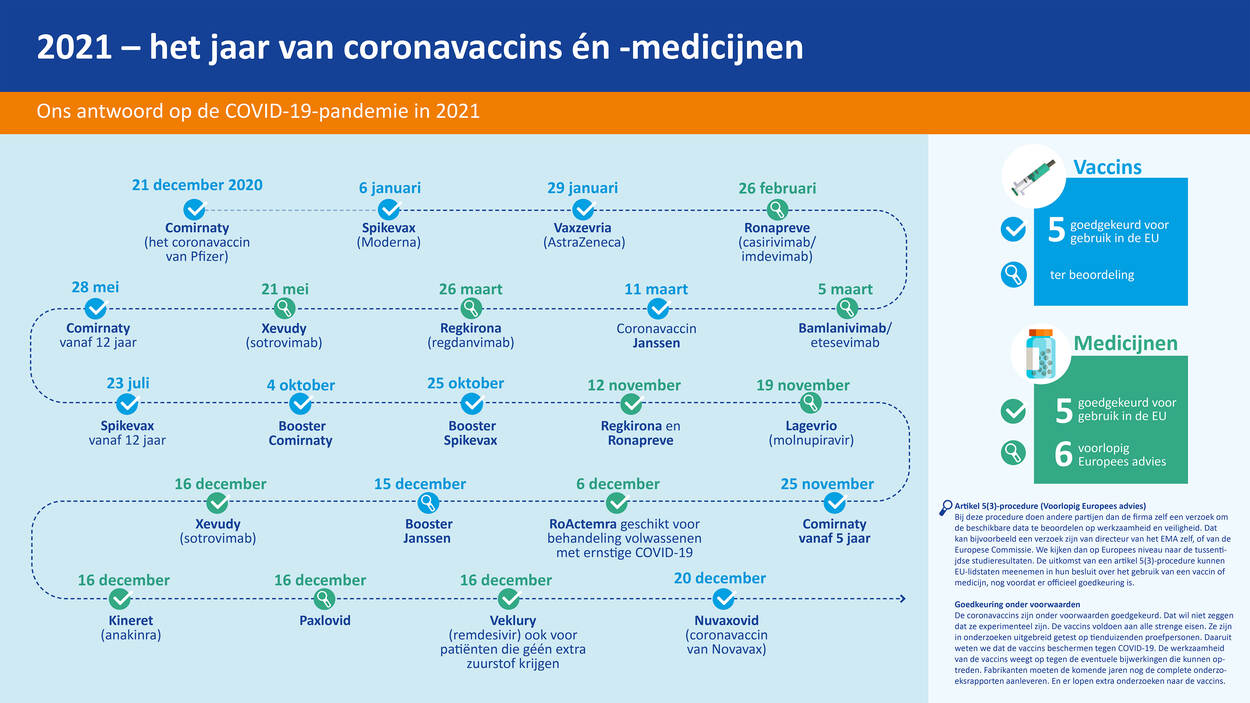
2021 – het jaar van coronavaccins én -medicijnen
Ons antwoord op de COVID-19-pandemie in 2021
Vaccins
5 goedgekeurd voor gebruik in de EU
21 december (2020) - Comirnaty (Pfizer)
6 januari - Spikevax (Moderna)
29 januari - Vaxzevria (AstraZeneca)
11 maart - Coronavaccin Janssen
28 mei - Comirnaty vanaf 12 jaar
23 juli - Spikevax vanaf 12 jaar
4 oktober - Booster Comirnaty
25 oktober - Booster Spikevax
25 november - Comirnaty vanaf 5 jaar
15 december - Booster Janssen
20 december - Nuvaxovid (coronavaccin van Novavax)
Medicijnen
5 goedgekeurd voor gebruik in de EU
6 voorlopig Europees advies
26 februari - Ronapreve (casirivimab/imdevimab)
5 maart - Bamlanivimab/etesevimab
26 maart - Regkirona (regdanvimab)
21 mei - Xevudy (sotrovimab)
12 november - Regkirona, Ronapreve
19 november - Lagevrio (molnupiravir)
6 december - RoActemra voor volwassenen met ernstige COVID-19
16 december - Xevudy (sotrovimab), Kineret (anakinra), Paxlovid, Veklury ook voor patienten die géén extra zuurstof krijgen
Artikel 5(3)-procedure (Voorlopig Europees advies)
Bij deze procedure doen andere partijen dan de firma zelf een verzoek om de beschikbare data te beoordelen op werkzaamheid en veiligheid. Dat kan bijvoorbeeld een verzoek zijn van directeur van het EMA zelf, of van de Europese Commissie. We kijken dan op Europees niveau naar de tussentijdse studieresultaten. De uitkomst van een artikel 5(3)-procedure kunnen EU-lidstaten meenemen in hun besluit over het gebruik van een vaccin of medicijn, nog voordat er officieel goedkeuring is.
Goedkeuring onder voorwaarden
De coronavaccins zijn onder voorwaarden goedgekeurd. Dat wil niet zeggen dat ze experimenteel zijn. De vaccins voldoen aan alle strenge eisen. Ze zijn in onderzoeken uitgebreid getest op tienduizenden proefpersonen. Daaruit weten we dat de vaccins beschermen tegen COVID-19. De werkzaamheid van de vaccins weegt op tegen de eventuele bijwerkingen die kunnen optreden. Fabrikanten moeten de komende jaren nog de complete onderzoeksrapporten aanleveren. En er lopen extra onderzoeken naar de vaccins.
Een grotere versie van deze infographic is als download beschikbaar.
Communicatie
Geen enkel onderwerp kreeg het afgelopen jaar zoveel aandacht in de media als de coronavaccins. Daarmee kwam ook het CBG nadrukkelijk in de spotlights te staan. Als bron van betrouwbare, wetenschappelijke, onafhankelijke informatie heeft het CBG daarom actief de media opgezocht om vragen te beantwoorden. Dat deden we onder meer met persconferenties. Een logische, maar wel nieuwe stap in de CBG-geschiedenis. Uiteindelijk hielden we in 2021 acht persconferenties.


Ook consumenten en patiënten wisten het CBG steeds beter te vinden, als het gaat om het coronavirus, de vaccins en medicijnen. Via de contactformulieren op de website kwamen in de loop van 2021 meer dan 1.000 directe vragen over COVID-19 binnen, en ook op sociale media beantwoordden we talloze vragen. In live uitzendingen op YouTube beantwoordden experts vragen over coronavaccins:
- 31 januari: Het Grootste Coronaspreekuur – Vragen over vaccins
Onder leiding van presentatrice Merel Westrik beantwoordden Diederik Gommers (NVIC), hoogleraar immunologie Marjolein van Egmond (Amsterdam UMC) en CBG-voorzitter Ton de Boer vragen over coronavaccins. Het programma was live te zien op YouTube en op SBS6.
- 12 juli: Junior coronacollege: vragen over vaccins’
Voorzitter Ton de Boer, kinderarts/epidemioloog Patricia Bruijning (UMC Utrecht) en ethicus Naomi van Steenbergen (Universiteit Utrecht) gaven antwoord op vragen van middelbare scholieren over coronavaccins. Het college was online te volgen en werd op locatie door scholieren bijgewoond.
Betrouwbare én begrijpelijke informatie voor iedereen
Het Junior coronacollege en het Coronaspreekuur speelden in op een behoefte van het publiek: antwoorden op de meest gestelde vragen over coronavaccins en -medicijnen. Als aanvulling op de officiële bijsluiter ontwikkelden we samen met het RIVM voor elk coronavaccin een ‘Vaccin in het kort’. Daarin staat op één A4 in begrijpelijke taal de voor- en nadelen van het vaccin. Het is een nieuwe, visuele korte vorm van vaccininformatie, die onder meer beschikbaar is via de websites van het CBG en via coronavaccinatie.nl. In 2021 is ‘Vaccin in het kort’ voor SpikeVax en Comirnaty ook verspreid en uitgedeeld bij een groot aantal priklocaties, in samenwerking met het RIVM en de GGD's.'Vaccin in het kort voor kinderen' is daarnaast ook meegestuurd met de uitnodiging voor de coronavaccinatie voor kinderen van 5 tot en met 11 jaar.