Om een geneesmiddel of vaccin voor mensen* op de markt te mogen brengen, heeft een farmaceutisch bedrijf een handelsvergunning nodig. Het hoofdstuk ‘Procedures om een geneesmiddel of vaccin op de markt te brengen’ gaat specifieker in op de verschillende routes die er zijn om een vergunning voor een geneesmiddel te verkrijgen.
Europese comités
Bij twee wetenschappelijke comités van het Europees medicijnagentschap (EMA) komen de lijnen samen van de beoordeling van geneesmiddelen voor mensen in het kader van de Europese centrale procedure: het Committee for Medicinal Products for Human Use (CHMP) en het Pharmacovigilance Risk Assessment Committee (PRAC). In deze comités zitten vertegenwoordigers van alle EU-landen. De comités komen maandelijks bijeen bij het EMA in Amsterdam. In 2021 hebben de comités, net als in 2020, op afstand via videoverbinding vergaderd vanwege de beperkingen rondom de coronapandemie.
Als Nederland rapporteur is, voert een team van CBG medewerkers de beoordeling van het dossier uit. De samenstelling van het team is afhankelijk van het geneesmiddel en van de onderwerpen die in het kader van de beoordeling moeten worden beantwoord. Vervolgens worden de uitkomsten van de beoordeling voorgelegd aan het College, waarna het College adviseert met welk voorstel de Nederlandse CHMP- of PRAC-leden de bespreking in de betreffende comités ingaan.
Voor toewijzing van rapporteurschappen en co-rapporteurschappen hanteert het EMA criteria waarbij toewijzing plaatsvindt op basis van de best beschikbare expertise in de lidstaten. Hierbij is ook ruimte voor landen die in het verleden minder vaak rapporteur zijn geweest.
De toewijzing van co-rapporteurschappen is bij de PRAC anders dan bij de CHMP: het land dat CHMP Rapporteur is, wordt automatisch PRAC Co-rapporteur.
Naast de CHMP en de PRAC bestaan op het gebied van geneesmiddelen voor mensen in de centrale procedure vier andere wetenschappelijke comités bij het EMA:
- het Committee for Orphan Medicinal Products (COMP);
- het Pediatric Committee (PDCO);
- het Herbal Medicinal Products Committee (HMPC) en
- het Committee on Advanced Therapies (CAT).
Binnen elk wetenschappelijk comité van het EMA zijn verschillende werkgroepen actief. Een voorbeeld hiervan is de Scientific Advice Working Party (SAWP).
De coördinatie van het Europese werk in het kader van de decentrale en wederzijdse erkenningsprocedures is belegd bij de Coordination Group for Mutual Recognition and Decentralised Procedures human (CMDh). De CMDh is een wetenschappelijk comité van de lidstaten, maar vergadert, net als de andere comités, bij het EMA en wordt ook door het EMA ondersteund.
Toegewezen (co-)rapporteurschappen
| Co-rapporteur | Rapporteur | |
|---|---|---|
| 2017 | 6 | 7 |
| 2018 | 5 | 18 |
| 2019 | 11 | 24 |
| 2020 | 10 | 19 |
| 2021 | 2 | 21 |
Toegewezen (co-)rapporteurschappen
| Land | Aantal |
|---|---|
| Oostenrijk | 19 |
| België | 5 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Tsjechië | 8 |
| Duitsland | 35 |
| Denemarken | 22 |
| Estland | 10 |
| Griekenland | 0 |
| Spanje | 8 |
| Finland | 9 |
| Frankrijk | 18 |
| Kroatië | 4 |
| Hongarije | 2 |
| Ierland | 12 |
| IJsland | 4 |
| Italië | 6 |
| Litouwen | 8 |
| Luxemburg | 0 |
| Letland | 3 |
| Malta | 3 |
| Nederland | 23 |
| Noorwegen | 6 |
| Polen | 16 |
| Portugal | 10 |
| Roemenië | 4 |
| Zweden | 19 |
| Slovenië | 6 |
| Slowakije | 4 |
| Verenigd Koninkrijk | 0 |
De CHMP is onder andere verantwoordelijk voor het beoordelen van centrale aanvragen voor handelsvergunningen van geneesmiddelen.
Het aantal (co-)rapporteurschappen dat aan het CBG is toegewezen is in 2021 wat gedaald ten opzichte van het jaar daarvoor.
In 2021 heeft Duitsland de meeste (co-)rapporteurschappen toegewezen gekregen. Het CBG volgt op een tweede plek. Daarna maken Denemarken, Oostenrijk en Zweden de top vijf compleet. Er zijn vier landen die geen (co‑)rapporteurschappen toegewezen kregen.
Meer Europese samenwerking
Het CBG heeft ook een belangrijke rol in multinationale beoordelingsteams, de zogenoemde MNAT’s (Multinational Assessment Teams). In deze teams wordt een rapporteurschap door meerdere landen opgepakt. Daardoor krijgen ook landen met minder ervaring in rapporteurschappen de kans om ervaring op te doen. Van de 23 CHMP (co)rapporteurschappen die het CBG in 2021 toegewezen kreeg, zijn er 9 als een MNAT toegewezen. In de meeste gevallen nam het deelnemende land binnen de MNAT het beoordelen van de kwaliteitsaspecten van het geneesmiddel voor zijn rekening. Het aantal MNAT-samenwerkingsverbanden waarbij het CBG was betrokken, was in 2021 lager dan in 2020. Echter, het bevorderde evengoed de Europese samenwerking (zie ook de paragraaf International Collaboration Program). Het hielp het CBG ook om de zeer hoge werklast te beheersen, in het bijzonder op het terrein van de kwaliteitsbeoordeling.
Toegewezen rapporteurschappen geneesmiddelenbewaking (PRAC)
De PRAC speelt als geneesmiddelenbewakingscomité een belangrijke rol bij het toezicht op de risico’s van geneesmiddelen voor mensen in Europa. De PRAC geeft aanbevelingen aan de CHMP en de CMDh over de risico’s van geneesmiddelen die zijn of worden toegelaten in de Europese Unie.
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Land | Aantal |
|---|---|
| Oostenrijk | 10 |
| België | 0 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Tsjechië | 5 |
| Duitsland | 18 |
| Denemarken | 15 |
| Estland | 0 |
| Griekenland | 0 |
| Spanje | 4 |
| Finland | 10 |
| Frankrijk | 4 |
| Kroatië | 0 |
| Hongarije | 0 |
| Ierland | 8 |
| IJsland | 0 |
| Italië | 4 |
| Litouwen | 1 |
| Luxemburg | 0 |
| Letland | 2 |
| Malta | 2 |
| Nederland | 22 |
| Noorwegen | 1 |
| Polen | 8 |
| Portugal | 1 |
| Roemenië | 0 |
| Zweden | 10 |
| Slovenië | 0 |
| Slowakije | 0 |
| Verenigd Koninkrijk | 0 |
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Overige | Nieuwe stoffen | |
|---|---|---|
| 2017 | 0 | 14 |
| 2018 | 5 | 11 |
| 2019 | 12 | 19 |
| 2020 | 9 | 11 |
| 2021 | 5 | 17 |
In 2021 kreeg het CBG iets meer PRAC (co-)rapporteurschappen toegewezen dan een jaar eerder.
Van de 22 PRAC (co-)rapporteurschappen die in 2021 aan het CBG zijn toegewezen, zijn er 17 voor nieuwe actieve stoffen. De overige (co-)rapporteurschappen betreffen generieken en biosimilars.
Met 22 PRAC (co-)rapporteurschappen heeft het CBG een blijvende vooraanstaande rol binnen Europa. Het CBG heeft in 2021 de meeste (co-)rapporteurschappen toegewezen gekregen. Andere hoofdrolspelers zijn Duitsland en Denemarken.
Het CBG is in Europees verband ook verantwoordelijk voor de geneesmiddelbewaking van 100 werkzame stoffen. Dit betekent dat het CBG voor deze stoffen verantwoordelijk is voor het analyseren van gegevens in de Europese databank van vermoedelijke bijwerkingen (Eudravigilance databank) en voor het identificeren van signalen van mogelijke nieuwe of veranderde risico’s.
Gestarte aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
Het aantal gestarte procedures waarbij Nederland het referentieland (RMS) was, is vergelijkbaar met 2020.
In Europa valt op dat Nederland en Duitsland met respectievelijk 162 en 248 gestarte DCP-aanvragen samen ongeveer 35% van alle DCP- en MRP-procedures leiden.
Gestarte RMS-aanvragen via de decentrale procedure (DCP) en wederzijdse erkenningsprocedure (MRP)
| MRP | DCP | |
|---|---|---|
| 2017 | 70 | 230 |
| 2018 | 57 | 211 |
| 2019 | 60 | 235 |
| 2020 | 85 | 174 |
| 2021 | 93 | 162 |
Gestarte RMS-aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
| Land | DCP en MRP |
|---|---|
| Oostenrijk | 61 |
| België | 7 |
| Bulgarije | 0 |
| Cyprus | 2 |
| Tsjechië | 61 |
| Duitsland | 310 |
| Denemarken | 105 |
| Estland | 25 |
| Griekenland | 0 |
| Spanje | 27 |
| Finland | 35 |
| Frankrijk | 7 |
| Kroatië | 22 |
| Hongarije | 73 |
| Ierland | 38 |
| Ijsland | 40 |
| Italië | 11 |
| Litouwen | 12 |
| Letland | 17 |
| Malta | 68 |
| Nederland | 255 |
| Noorwegen | 6 |
| Polen | 49 |
| Portugal | 116 |
| Roemenië | 1 |
| Zweden | 135 |
| Slovenië | 18 |
| Slowakije | 9 |
| Verenigd Koninkrijk | 0 |
International Collaboration Program
Met 2021 is het vierde volledige jaar van het International Collaboration Program (ICP) ingegaan. Doel van het ICP is delen van kennis en ervaring met medicijnautoriteiten uit kleinere lidstaten om hen te helpen een grotere rol in het Europese netwerk op zich te nemen. De 10 deelnemende landen zijn Bulgarije, Estland, IJsland, Letland, Litouwen, Kroatië, Malta, Portugal, Slovenië en Slowakije. Zij ontvangen (naar behoefte) bijdragen voor salarissen van nieuw aangetrokken beoordelaars, ondersteuning op het gebied van opleidingen (in 2021 alles digitaal) en maatwerk voor ondersteuning bij lopende procedures en (peer) reviews. De deelnemende landen participeren inmiddels volop in Multi National Assessments Teams (voor centrale aanvragen) en andere samenwerkingsvormen. Als gevolg van de coronapandemie zijn de periodieke reizen naar de ICP-landen grotendeels uitgesteld tot 2022 en vindt samenwerking meer digitaal plaats. In de zomer van 2021 zijn wel enkele landen bezocht (Malta, IJsland, Slovenië en Slowakije). Het primaire accent ligt op humane beoordelingen, maar ook op het terrein van inspecties wordt samengewerkt. Dat stond in 2021 op een lager pitje vanwege de pandemie. Ook zijn er internationale activiteiten uitgebouwd op het gebied van veterinaire geneesmiddelen, onder andere op het gebied van antibioticaresistentie.
De samenwerking tussen de ICP-landen werkt inmiddels wederzijds. Meerdere samenwerkingen tussen ICP-landen op het gebied van opleidingen, trainingen en andere vormen van kennisuitwisseling hebben plaatsgevonden. In diverse gevallen werd dit direct of indirect gefaciliteerd door het ICP. Aangezien er nog geen verlenging van het programma is toegekend vanuit de middelen die het kabinet uittrekt voor internationale samenwerking, is het jaar 2022 vooralsnog het laatste jaar van het ICP.
Aanvragen via de nationale procedure
Het aantal ingediende aanvragen via de nationale procedure (uitgezonderd parallelimport, inclusief duplexprocedures) blijft schommelen rond de 60 per jaar. De meeste aanvragers geven de voorkeur aan een Europese procedure (centraal en DCP), waardoor het product in meerdere Europese landen tegelijk een handelsvergunning krijgt.
Ingediende aanvragen via de nationale procedure
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal ingediende aanvragen via de nationale procedure | 66 | 57 | 67 | 87 | 59 |
Nationale aanvragen parallelimport
In tegenstelling tot 2019 en 2020 is het aantal aanvragen voor een parallelhandelsvergunning in 2021 gestegen. In 2021 was het totale aantal parallel aanvragen 20% hoger dan in het jaar ervoor.
Ingediende aanvragen parallelimport
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal ingediende aanvragen parallelimport | 445 | 521 | 375 | 316 | 486 |
Aantal ingeschreven handelsvergunningen
In 2021 was het totaal aantal ingeschreven handelsvergunningen in Nederland vergelijkbaar met het jaar ervoor.
Aantal ingeschreven handelsvergunningen
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal ingeschreven handelsvergunningen | 14133 | 14288 | 14288 | 13565 | 13452 |
Intrekkingen van handelsvergunning na inschrijving
Als een firma een verzoek tot intrekking van de handelsvergunning doet, bekijkt het CBG of het een kritisch product betreft. Bijvoorbeeld of er vergelijkbare middelen in dezelfde geneesmiddelgroep zitten. Is dit niet het geval? Dan wordt onderzocht welke mogelijkheden er zijn om het product voor de Nederlandse patiënt te behouden. Dit doet het CBG in overleg met de vergunninghouder.
Over de jaren heen is het aantal intrekkingen van handelsvergunningen redelijk constant.
Intrekkingen na inschrijving
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal intrekkingen | 1246 | 1209 | 1390 | 1649 | 1150 |
Afgesloten zaken (inclusief variaties)
Het CBG handelt wekelijks honderden zaken af. Van vergunningaanvragen en aanvragen voor indicatie-uitbreiding tot kleinere variaties, zoals de wijziging van een fabrikant in het dossier, het toevoegen van een bijwerking of het aanpassen van de houdbaarheid van een geneesmiddel.
Het aantal zaken dat per jaar door het CBG wordt afgehandeld, is over de jaren heen gestegen. Het aantal in 2021 is vergelijkbaar met het jaar ervoor.
Afgesloten zaken
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal afgesloten zaken, inclusief variaties | 19666 | 25071 | 28959 | 29521 | 29146 |
Wetenschappelijk advies
Door het geven van wetenschappelijk advies kan het CBG bijdragen aan verantwoorde ontwikkeling van geneesmiddelen, innovatie en early-patient access. Een wetenschappelijk advies kan gaan over alle aspecten van de productontwikkeling, zoals klinische of toxicologische, maar ook regulatoire aspecten. Het advies dient om een investeringszekerheid te verschaffen en is een wettelijke taak. Er bestaan zowel nationale als centrale (Europese) procedures voor het geven van wetenschappelijk advies. Het nationale advies valt als wettelijke taak onder de directe verantwoordelijkheid van het College. Centraal wetenschappelijk advies wordt opgesteld door de SAWP en betreft een Europese consensus. Het CBG is actief in zowel Europees als nationaal wetenschappelijk advies.
Aantal toegekende wetenschappelijk adviezen in Europa
Naar aanleiding van de COVID pandemie heeft het EMA een aanvullende categorie spoed-adviezen ingevoerd. In 2021 zijn er 79 van deze adviezen gegeven, waarbij Nederland aan 12 een bijdrage heeft geleverd.
Toegewezen wetenschappelijke adviezen via SAWP
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal toegewezen wetenschappelijke adviezen via SAWP | 135 | 130 | 142 | 140 | 146 |
Aantal nationale wetenschappelijke adviezen
Het aantal nationale wetenschappelijke adviezen is in 2021 iets gedaald ten opzichte van 2020. Een mogelijke oorzaak voor de daling in 2020 en 2021 is een verschuiving van prioriteiten binnen de farmaceutische industrie door de coronapandemie. In het algemeen kan gesteld worden dat in 2020 en 2021 interacties tussen ontwikkelaars en het CBG hebben geleden onder de lockdown.
Het CBG geeft ook advies op maat waarbij startups, kleine bedrijven en academische groepen de mogelijkheid hebben om advies te vragen tegen een gereduceerd tarief. Hiermee wordt innovatie bij universiteiten en kleine bedrijven gestimuleerd. Vooral academische groepen wisten het CBG in 2021 steeds beter te vinden voor advies op maat.
Binnen dit advies op maat is door de coronapandemie een speciale categorie voor COVID-19 advies ontstaan. Dit advies is bedoeld ter ondersteuning van onderzoek waarbij medicijnen en vaccins getest worden als mogelijke preventie en behandeling van COVID-19. Deze adviezen worden versneld afgehandeld. In 2021 zijn er 2 adviesaanvragen voor COVID-19 ontvangen.
Het CBG was net als in voorgaande jaren actief betrokken bij drug rediscovery-projecten van ZonMw. ZonMw is de Nederlandse instantie die gezondheidsonderzoek en -innovatie stimuleert en financiert. Door beoordelingen van projectaanvragen voor onderzoek naar geneesmiddelen die in de praktijk soms al off label worden ingezet, draagt het CBG bij aan een mogelijke on label toepassing. Hieraan zijn belangrijke voordelen verbonden voor voorschrijvers en patiënten, maar ook voor de geneesmiddelenbewaking. De geregistreerde toepassing vormt namelijk onderdeel van de productinformatie, waaronder de bijsluiter.
Daarnaast heet het CBG in het kader van het STARS-project (Strengthening Training of Academia in Regulatory Science) een vierdaagse training gegeven voor zo’n 120 academici en clinici op Europees niveau. Ook was er via STARS in 2021 een Europese workshop om academische geneesmiddelenontwikkeling te stimuleren. Ook zijn eerdere initiatieven zoals gezamenlijke wetenschappelijke adviezen met het Zorginstituut Nederland (ZIN) en de Centrale Commissie Mensgebonden Onderzoek (CCMO), doorgegaan.
Geopende zaken wetenschappelijke adviezen nationaal
| Wetenschappelijk advies | Wetenschappelijk advies op maat (incl. Covid-19 advies) | |
|---|---|---|
| 2017 | 101 | 12 |
| 2018 | 110 | 6 |
| 2019 | 115 | 14 |
| 2020 | 103 | 10 |
| 2021 | 95 | 5 |
Pilot parallelle Procedures CBG-ZIN
In de pilot Parallelle Procedures CBG-ZIN (Zorginstituut Nederland) is door het CBG, samen met de koepelorganisaties Vereniging Innovatieve Geneesmiddelen (VIG) en HollandBIO, een werkwijze ontwikkeld voor meer parallelle procedures voor registratie en vergoedingstrajecten. Deze werkwijze is ontwikkeld in plaats van de huidige processen die elkaar opvolgen. Dit houdt in dat op het moment dat een geneesmiddel voor registratie wordt beoordeeld, ook al de beoordeling voor vergoeding start. Zo is er vlak na registratie ook duidelijkheid over de vergoedingsstatus van het geneesmiddel. Om dit mogelijk te maken, wordt in een aantal pilotprocedures (registratie- en vergoedingsprocedure van een geneesmiddel) de werkwijze verder vormgegeven en getoetst.
In 2021 is de (eind)rapportage over de pilot aangeboden aan het ministerie van VWS. Het CBG en het ZIN hebben hier een toelichting op gegeven en de resultaten van het project zijn besproken met het ministerie. Het ministerie is het eens met de conclusies in de rapportage, en benadrukt het succes van de pilot. Het voornemen is om de procedure structureel aan te bieden als alternatief van de huidige vergoedingsaanvraagprocedure. Inmiddels worden 7 producten beoordeeld binnen de parallelle procedure en zijn 3 procedures succesvol afgerond. Uit de pilotprocedures blijkt dat er drie maanden eerder duidelijkheid is over de vergoedingsstatus van parallel beoordeelde geneesmiddelen. Het CBG benadrukt het belang van de parallelle procedure en zal in 2022 gezamenlijk met het ZIN stappen zetten om de procedure structureel op te nemen in de werkzaamheden.
Bijwerkingen
Het signaleren en beoordelen van bijwerkingen van een geneesmiddel, ook als het middel al is ingeschreven, is een kerntaak van het CBG. In opdracht van het CBG verzamelt, registreert en analyseert het Bijwerkingencentrum Lareb de meldingen van vermoedelijke bijwerkingen die afkomstig zijn van medische beroepsbeoefenaren en van patiënten. Relevante bevindingen uit deze analyses bespreekt het Lareb met het CBG.
In 2021 hebben het Lareb en het CBG 106 analyses van meldingen van vermoedelijke bijwerkingen besproken. Dit zijn er veel meer dan in het jaar ervoor, toen waren dit 62 analyses. Een reden hiervoor zijn de toegenomen COVID-19-beoordelingen, naast de reguliere beoordelingen.
Van de 106 analyses zijn er 21 uitgewerkt voor bespreking in de Collegevergadering en 2 bij de Commissie Praktijk van het CBG. De overige analyses hebben hun weg gevonden in onder andere lopende procedures bij het CBG en het blijven monitoren van de meldingen.
Zoals eerder in dit hoofdstuk genoemd, is het CBG in Europees verband verantwoordelijk voor de signaaldetectie van 100 werkzame stoffen (of combinaties van werkzame stoffen). Daarnaast is het CBG PRAC Rapporteur voor 109 werkzame stoffen (of combinaties van werkzame stoffen). Voor deze stoffen beoordeelt het CBG alle signalen van mogelijke nieuwe of veranderde risico’s. In 2021 heeft het CBG 19 signalen beoordeeld in Europees verband.
Daarnaast zorgt het CBG voor de beoordeling van Periodic Safety Update Reports (PSUR) van deze werkzame stoffen, binnen de PSUR Single Assessment (PSUSA) procedure. Een PSUR, of periodieke veiligheidsrapportage, is een uitgebreide en kritische analyse van de baten-risicobalans van een product. Het geeft de medicijnautoriteiten op vastgestelde tijdstippen na registratie een update over de wereldwijde ervaringen met de veiligheid van een product. Het indienen van een PSUR wordt bepaald door middel van een risico gebaseerde benadering. De frequentie waarmee PSUR's moeten worden ingediend, varieert. In 2021 heeft het CBG namens Europa 103 PSUSA-beoordelingen uitgevoerd.
Signalen van Lareb
| Besproken in College | In commissie Praktijk | Overig | |
|---|---|---|---|
| 2018 | 11 | 3 | 36 |
| 2019 | 16 | 2 | 47 |
| 2020 | 15 | 3 | 44 |
| 2021 | 21 | 2 | 83 |
Direct Healthcare Professional Communication
In geval van dringende en/of belangrijke veiligheidsissues worden medische beroepsbeoefenaren door middel van een brief, een zogenoemde Direct Healthcare Professional Communication (DHPC), op de hoogte gebracht. In 2021 zijn 26 DHPC’s verstuurd.
Direct Healthcare Professional Communications
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal DHPC's | 21 | 31 | 29 | 22 | 26 |
Meldingen van verwachte tijdelijke leveringsproblemen
Het Meldpunt Geneesmiddelentekorten en -defecten ziet een stabilisatie van het aantal meldingen van verwachte leveringsproblemen. In 2021 heeft het Meldpunt 3.660 meldingen van verwachte leveringsproblemen ontvangen voor in totaal 1.835 verschillende geneesmiddelen. Het aantal verschillende medicijnen waarvoor leveringsproblemen zijn gemeld is zelfs 12% minder ten opzichte van vorig jaar.
Een melding bij het Meldpunt betekent niet dat er daadwerkelijk een tekort zal ontstaan. Bedrijven melden steeds vaker ook uit voorzorg, terwijl op een later moment blijkt dat de levering toch geen hinder ondervindt. Of de leveringsproblemen worden voldoende ondervangen door voorraden die nog in de keten beschikbaar zijn.
Ongeveer de helft (49%) van de verwachte leveringsproblemen is veroorzaakt door vertraging van de productie of vrijgifte van het eindproduct. Bedrijven noemden dit in voorgaande jaren ook als voornaamste reden. Daarnaast speelden leveringsproblemen door een toegenomen vraag een belangrijke rol (25%). Deze toename komt in de meeste gevallen door een leveringsprobleem van een vergelijkbaar middel bij een of meerdere andere bedrijven.
Het Meldpunt controleert voor iedere melding of er alternatieven in Nederland beschikbaar zijn. Voor veel geneesmiddelen is dit het geval, waardoor leveringsproblemen kunnen worden opgevangen. Als dit niet mogelijk is, zoeken het CBG en de IGJ met bedrijven en zorgverleners naar een andere oplossing. Zoals toestemming voor een buitenlandse verpakking, een alternatief geneesmiddel uit het buitenland of een apotheekbereiding, of een nieuwe handelsvergunning voor een geneesmiddel met dezelfde werkzame stof.
Voor 99% van de geneesmiddelen die tijdelijk niet beschikbaar waren, was een passende oplossing beschikbaar voor de patiënt. Dit neemt niet weg dat daadwerkelijke leveringsproblemen extra werk opleveren voor apothekers en dat het wisselen in sommige gevallen vervelend kan zijn voor patiënten.
Meldingen van verwachte leveringsproblemen
| 2017 | 2018 | 2019 | 2020 | 2021 | |
|---|---|---|---|---|---|
| Aantal meldingen van verwachte leveringsproblemen | 536 | 1390 | 3070 | 3723 | 3660 |
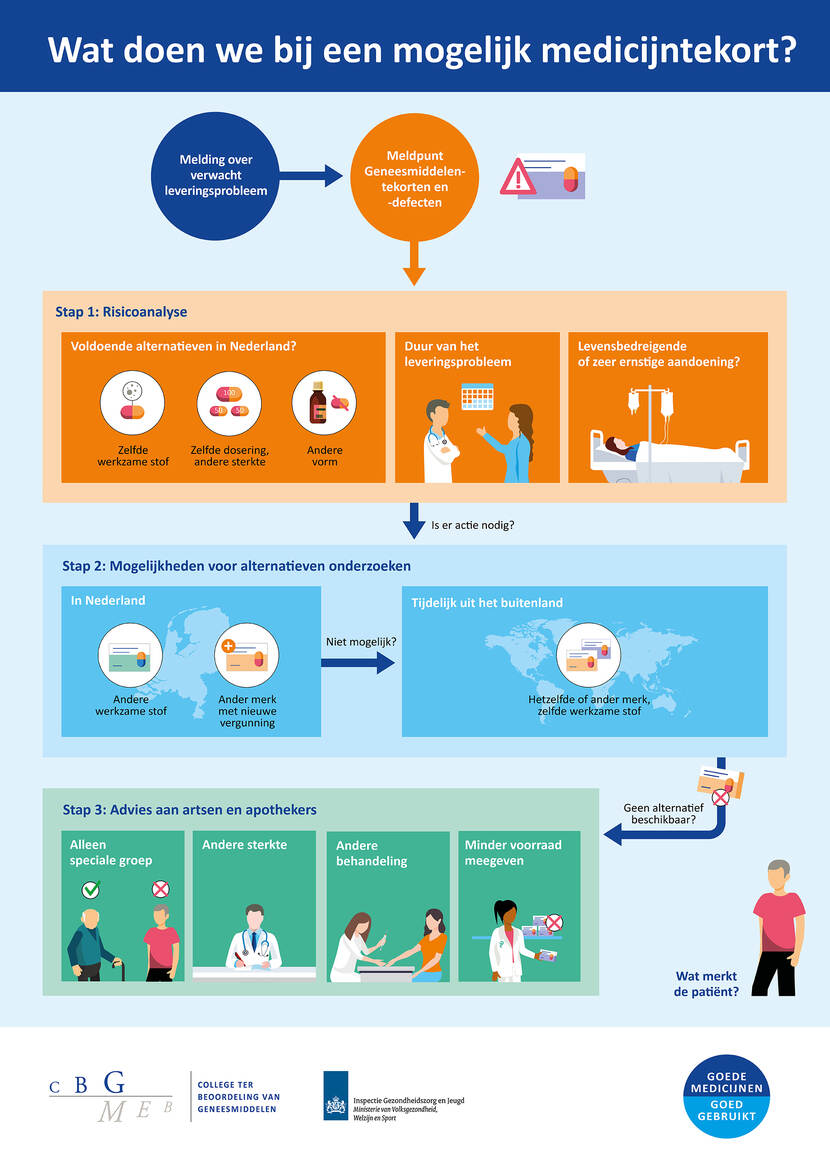
In deze infographic geven we schematisch weer welke stappen we kunnen nemen bij een mogelijk medicijntekort.
Wat doen we bij een mogelijk medicijntekort?
Melding over verwacht leveringsprobleem --> Meldpunt Geneesmiddelentekorten en -defecten -->
Stap 1: Risicoanalyse
- Voldoende alternatieven in Nederland?
- Zelfde werkzame stof
- Zelfde dosering, andere sterkte
- Andere vorm
- Duur van het leveringsprobleem
- Levensbedreigende of zeer ernstige aandoening?
Is er actie nodig? Naar stap 2.
Stap 2: Mogelijkheden voor alternatieven onderzoeken
- In Nederland
- Andere werkzame stof
- Ander merk met nieuwe vergunning
Niet mogelijk?
- Tijdelijk uit het buitenland
- Hetzelfde of ander merk, zelfde werkzame stof
Geen alternatief beschikbaar? Naar stap 3.
Stap 3: Advies aan artsen en apothekers
- Alleen speciale groep
- Andere sterkte
- Andere behandeling
- Minder voorraad meegeven
*In dit hoofdstuk worden kruidengeneesmiddelen en homeopathica buiten beschouwing gelaten. Deze middelen komen in een apart hoofdstuk aan bod: Botanicals en nieuwe voedingsmiddelen.