Om een geneesmiddel of vaccin voor mensen* op de markt te mogen brengen, heeft een farmaceutisch bedrijf een handelsvergunning nodig. Het hoofdstuk ‘Procedures om een geneesmiddel of vaccin op de markt te brengen’ gaat specifieker in op de verschillende routes die er zijn om een vergunning voor een geneesmiddel te verkrijgen.
Europese comités
Bij twee wetenschappelijke comités van het Europees medicijnagentschap (EMA) komen de lijnen samen van de beoordeling van geneesmiddelen voor mensen in het kader van de Europese centrale procedure: de Committee for Medicinal Products for Human Use (CHMP) en het Pharmacovigilance Risk Assessment Committee (PRAC). In deze comités zitten vertegenwoordigers van alle EU-landen. De comités komen maandelijks bijeen bij het EMA in Amsterdam. In 2020 hebben de comités op afstand via videoverbinding vergaderd, vanwege de beperkingen rondom de coronapandemie.
Als Nederland Rapporteur is, houdt dat in dat een team van CBG’ers de beoordeling van het dossier uitvoert. De samenstelling van het team is afhankelijk van het geneesmiddel en van de onderwerpen die in het kader van de beoordeling moeten worden beantwoord. Vervolgens worden de uitkomsten van de beoordeling voorgelegd aan het College, waarna het College besluit met welk voorstel de Nederlandse CMHP- of PRAC-leden de bespreking in de betreffende comités ingaan.
Voor toewijzing van rapporteurschappen en co-rapporteurschappen hanteert het EMA criteria waarbij toewijzing plaatsvindt op basis van de best beschikbare expertise in de lidstaten. Hierbij is ook ruimte voor landen die in het verleden minder vaak rapporteur zijn geweest.
De toewijzing van co-rapporteurschappen is bij de PRAC anders dan bij de CHMP: het land dat CHMP Rapporteur is, wordt automatisch PRAC Co-rapporteur.
Naast de CHMP en de PRAC bestaan op het gebied van geneesmiddelen voor mensen in de centrale procedure vier andere wetenschappelijke comités bij het EMA: het Committee for Orphan Medicinal Products (COMP), het Pediatric Committee (PDCO), het Herbal Medicinal Products Committee (HMPC) en het Committee on Advanced Therapies (CAT). Binnen elk wetenschappelijk comité van het EMA zijn verschillende werkgroepen actief. Een voorbeeld hiervan is de Scientific Advice Working Party (SAWP).
De coördinatie van het Europese werk in het kader van de decentrale en wederzijdse erkenningsprocedures is belegd bij de Coordination Group for Mutual Recognition and Decentralised Procedures human (CMDh). De CMDh is een wetenschappelijk comité van de lidstaten, maar vergadert, net als de andere comités, bij het EMA en wordt ook door het EMA ondersteund.
Toegewezen (co-)rapporteurschappen
| Co-rapporteur | Rapporteur | |
|---|---|---|
| 2016 | 4 | 8 |
| 2017 | 6 | 7 |
| 2018 | 5 | 18 |
| 2019 | 11 | 24 |
| 2020 | 10 | 19 |
Toegewezen (co-)rapporteurschappen
| Land | Aantal |
|---|---|
| Oostenrijk | 17 |
| België | 4 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Tsjechië | 8 |
| Duitsland | 25 |
| Denemarken | 16 |
| Estland | 6 |
| Griekenland | 3 |
| Spanje | 9 |
| Finland | 8 |
| Frankrijk | 19 |
| Kroatië | 5 |
| Hongarije | 4 |
| Ierland | 11 |
| IJsland | 4 |
| Italië | 2 |
| Litouwen | 0 |
| Luxemburg | 0 |
| Letland | 8 |
| Malta | 1 |
| Nederland | 29 |
| Noorwegen | 4 |
| Polen | 10 |
| Portugal | 4 |
| Roemenië | 7 |
| Zweden | 18 |
| Slovenië | 5 |
| Slowakije | 5 |
| Verenigd Koninkrijk | 0 |
De CHMP is onder andere verantwoordelijk voor het beoordelen van centrale aanvragen voor handelsvergunningen van geneesmiddelen.
Het aantal (co-)rapporteurschappen dat aan het CBG is toegewezen is in 2020 wat gedaald ten opzichte van het jaar daarvoor. In relatieve zin is het aandeel van het CBG van de totale hoeveelheid rapporteurschappen in Europa onveranderd op 12% gebleven. Dit komt doordat er in 2020 minder aanvragen via de centrale procedure binnenkwamen dan in 2019.
Het CBG heeft in 2020 net als vorig jaar de meeste (co-)rapporteurschappen toegewezen gekregen. Van de 30 deelnemende Europese landen kregen in 2020 vijf landen geen (co‑)rapporteurschappen toegewezen. Het Verenigd Koninkrijk is één van deze vijf landen; zij waren in 2020 tijdens de transitieperiode nog betrokken bij Europese procedures, maar mochten vanwege de Brexit geen (co-)rapporteurschappen meer op zich nemen.
Meer Europese samenwerking
Het CBG heeft ook een belangrijke rol in multinationale beoordelingsteams, de zogenoemde MNAT’s (multinational assessment teams). In deze teams wordt een rapporteurschap gezamenlijk, door meerdere landen, opgepakt. Daardoor krijgen ook landen met minder ervaring in rapporteurschappen de kans om ervaring op te doen. Van de 19 rapporteurschappen die het CBG in 2020 toegewezen kreeg, zijn er 13 als een MNAT toegewezen. In de meeste gevallen nam het deelnemende land binnen de MNAT het beoordelen van de kwaliteitsaspecten van het geneesmiddel voor zijn rekening. Nooit eerder was het aantal MNAT-samenwerkingsverbanden waarbij het CBG was betrokken zo groot. Het bevorderde de Europese samenwerking (zie ook de paragraaf International Collaboration Program), maar het hielp het CBG ook om de zeer hoge werklast te beheersen, in het bijzonder op het terrein van de kwaliteitsbeoordeling.
Pilot parallelle Procedures CBG-ZIN
In de pilot Parallelle Procedures CBG-ZIN is, samen met de koepelorganisaties Vereniging Innovatieve Geneesmiddelen (VIG) en HollandBIO, een werkwijze ontwikkeld voor meer parallelle procedures voor registratie en vergoedingstrajecten in plaats van de huidige elkaar opvolgende processen. Dit houdt in dat op het moment dat een geneesmiddel voor registratie wordt beoordeeld, ook al de beoordeling voor vergoeding start. Zo is er vlak na registratie ook duidelijkheid over de vergoedingsstatus van het geneesmiddel. Om dit mogelijk te maken, wordt in een aantal pilotprocedures (registratie- en vergoedingsprocedure van een geneesmiddel) de werkwijze verder vormgegeven en getoetst.
Tot nu toe zijn vier geneesmiddelen formeel geïncludeerd in de pilot. De beoordelingen voor twee daarvan zijn inmiddels afgerond en de andere twee worden binnenkort beoordeeld. Daarnaast zijn er gesprekken met meerdere fabrikanten om ook andere geneesmiddelen te beoordelen volgens de parallelle werkwijze.
Het is gebleken dat deze werkwijze duidelijk, voorspelbaar en praktisch uitvoerbaar is voor zowel het CBG, het Zorginstituut Nederland (ZIN) als de farmaceutische industrie. Daarnaast blijkt uit de eerste pilotprocedures dat er drie maanden eerder duidelijkheid is over de vergoedingsstatus van parallel beoordeelde geneesmiddelen. Het voornemen van het CBG en ZIN is om in de toekomst de parallelle procedure structureel te implementeren.
Toegewezen rapporteurschappen geneesmiddelenbewaking (PRAC)
De PRAC speelt als geneesmiddelenbewakingscomité een belangrijke rol bij het toezicht op de risico’s van geneesmiddelen voor mensen in Europa. De PRAC geeft aanbevelingen aan de CHMP en de CMDh over de risico’s van geneesmiddelen die zijn of worden toegelaten in de Europese Unie.
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Land | Aantal |
|---|---|
| Oostenrijk | 7 |
| België | 5 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Tsjechië | 5 |
| Duitsland | 15 |
| Denemarken | 8 |
| Estland | 0 |
| Griekenland | 0 |
| Spanje | 2 |
| Finland | 5 |
| Frankrijk | 9 |
| Kroatië | 3 |
| Hongarije | 0 |
| Ierland | 1 |
| IJsland | 0 |
| Italië | 5 |
| Litouwen | 0 |
| Luxemburg | 0 |
| Letland | 1 |
| Malta | 2 |
| Nederland | 20 |
| Noorwegen | 1 |
| Polen | 3 |
| Portugal | 6 |
| Roemenië | 0 |
| Zweden | 19 |
| Slovenië | 2 |
| Slowakije | 0 |
| Verenigd Koninkrijk | 0 |
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Overige | Nieuwe stoffen | |
|---|---|---|
| 2016 | 9 | 10 |
| 2017 | 0 | 14 |
| 2018 | 5 | 11 |
| 2019 | 12 | 19 |
| 2020 | 9 | 11 |
In 2020 kreeg het CBG minder PRAC rapporteurschappen toegewezen dan een jaar eerder. Dit komt voornamelijk omdat er in 2019 20% meer PRAC rapporteurschappen te verdelen waren dan in 2020. Van de 20 PRAC rapporteurschappen die in 2020 aan het CBG zijn toegewezen, zijn er 11 voor nieuwe actieve stoffen. De overige rapporteurschappen betreffen generieken en biosimilars.
Met 20 PRAC rapporteurschappen heeft het CBG een blijvende vooraanstaande rol binnen Europa. Opvallend is dat Nederland, Duitsland en Zweden gezamenlijk bijna de helft van de PRAC rapporteurschappen voor hun rekening nemen.
Het CBG is verder in Europees verband verantwoordelijk voor de geneesmiddelbewaking van 99 werkzame stoffen. Dit betekent dat het CBG voor deze stoffen verantwoordelijk is voor het analyseren van gegevens in de Europese databank van vermoedelijke bijwerkingen, de Eudravigilance databank, en voor het identificeren van signalen van mogelijke nieuwe of veranderde risico’s.
Gestarte aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
Het aantal gestarte procedures waarbij Nederland het referentieland (RMS) was, is ten opzichte van 2019 licht gedaald.
In Europa valt op dat Nederland en Duitsland met respectievelijk 174 en 232 gestarte DCP-aanvragen samen ongeveer 40% van alle DCP-procedures leiden.
Gestarte RMS-aanvragen via de decentrale procedure (DCP) en wederzijdse erkenningsprocedure (MRP)
| MRP | DCP | |
|---|---|---|
| 2016 | 61 | 243 |
| 2017 | 70 | 230 |
| 2018 | 57 | 211 |
| 2019 | 60 | 235 |
| 2020 | 85 | 174 |
Gestarte RMS-aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
| Land | DCP en MRP |
|---|---|
| Oostenrijk | 72 |
| België | 1 |
| Bulgarije | 0 |
| Cyprus | 5 |
| Tsjechië | 59 |
| Duitsland | 278 |
| Denemarken | 84 |
| Estland | 27 |
| Griekenland | 0 |
| Spanje | 21 |
| Finland | 30 |
| Frankrijk | 1 |
| Kroatië | 14 |
| Hongarije | 56 |
| Ierland | 34 |
| Ijsland | 24 |
| Italië | 3 |
| Litouwen | 6 |
| Letland | 12 |
| Malta | 43 |
| Nederland | 259 |
| Noorwegen | 9 |
| Polen | 23 |
| Portugal | 111 |
| Roemenië | 1 |
| Zweden | 103 |
| Slovenië | 15 |
| Slowakije | 13 |
| Verenigd Koninkrijk | 12 |
International Collaboration Program
Met 2020 is het derde jaar van het International Collaboration Program (ICP) ingegaan. De 10 deelnemende landen ontvangen (naar behoefte) bijdragen voor salarissen van nieuw aangetrokken beoordelaars, ondersteuning op het gebied van opleidingen, vaktechniek (in 2020 bijna alles digitaal) en maatwerk voor ondersteuning bij lopende procedures en (peer) reviews. De deelnemende landen participeren inmiddels volop in MNAT’s (voor centrale aanvragen) en andere samenwerkingsvormen. Als gevolg van de coronapandemie zijn de periodieke reizen naar de ICP-landen uitgesteld en vindt samenwerking meer digitaal plaats. Het primaire accent ligt op humane beoordelingen, maar ook op het terrein van inspecties wordt samengewerkt. Ook zijn er internationale activiteiten opgestart op het gebied van veterinaire geneesmiddelen, onder andere op het gebied van antibioticaresistentie.
De samenwerking binnen het ICP werkt inmiddels beide kanten op. Een aantal ICP-landen ondersteunt het CBG bij het beoordelen van procedures, wanneer er bij het CBG te weinig capaciteit beschikbaar is. Indien geen verlenging van het programma wordt toegekend vanuit de middelen die het kabinet uittrekt voor internationale samenwerking, is het jaar 2021 is het laatste jaar van het ICP‑programma.
Aanvragen via de nationale procedure
Het aantal ingediende nationale aanvragen (uitgezonderd parallelimport, inclusief duplexprocedures) is in 2020 verder gestegen ten opzichte van de jaren hiervoor. Deze toename wordt voornamelijk veroorzaakt door een toename in het aantal ingediende duplexprocedures (58 in 2020 ten opzichte van 43 in 2019). Een duplexregistratie is een registratie van een product, waarvan het dossier identiek is aan dat van een reeds ingeschreven product. In een duplexregistratieprocedure kan het CBG afzien van een volledige beoordeling, zodat de handelsvergunning snel kan worden afgegeven.
Het aantal aanvragen via de nationale procedure blijft in absolute getallen echter laag. In veruit de meeste gevallen wordt door aanvragers de voorkeur gegeven aan een Europese procedure (centraal en DCP), waardoor het product in meerdere Europese landen op de markt kan komen.
Ingediende aanvragen via de nationale procedure
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal ingediende aanvragen via de nationale procedure | 46 | 66 | 57 | 67 | 87 |
Nationale aanvragen parallelimport
De sterke daling van parallelimportaanvragen uit 2019 zet in 2020 verder door.
Ingediende aanvragen parallelimport
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal ingediende aanvragen parallelimport | 428 | 445 | 521 | 375 | 316 |
Aantal ingeschreven handelsvergunningen
Na jaren van geringe stijging van het aantal ingeschreven handelsvergunningen in Nederland is in 2020 een duidelijke afname te zien. Waar in voorgaande jaren het aantal inschrijvingen per jaar constant iets hoger lag dan het aantal ingetrokken handelsvergunningen in dat jaar, is dit in 2020 niet het geval. Niet alleen het aantal doorgehaalde handelsvergunningen ligt in 2020 beduidend hoger dan voorgaande jaren (zie grafiek Intrekkingen na inschrijving), ook het aantal afgegeven handelsvergunningen is in 2020 zo’n 30% lager dan in voorgaande jaren.
Aantal ingeschreven handelsvergunningen
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal ingeschreven handelsvergunningen | 14060 | 14133 | 14288 | 14288 | 13565 |
Intrekkingen van handelsvergunning na inschrijving
Als een firma een verzoek tot intrekking van de handelsvergunning doet, wordt gekeken of het een kritisch product betreft; bijvoorbeeld of er vergelijkbare middelen in dezelfde geneesmiddelgroep zitten. Is dit niet het geval? Dan onderzoekt het CBG welke mogelijkheden er zijn om het product voor de Nederlandse markt te behouden. Dit doet het CBG in overleg met de vergunninghouder.
Intrekkingen na inschrijving
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal intrekkingen | 1056 | 1246 | 1209 | 1390 | 1649 |
Afgesloten zaken (inclusief variaties)
Het CBG handelt wekelijks honderden zaken af; van vergunningaanvragen, aanvragen voor indicatie-uitbreiding tot kleinere variaties, zoals de wijziging van een fabrikant in het dossier, het toevoegen van een bijwerking of het aanpassen van de houdbaarheid van een geneesmiddel.
Het aantal zaken dat per jaar door het CBG wordt afgehandeld, is licht gestegen ten opzichte van 2019. Vorig jaar was een flinke stijging te zien, onder andere door de toename van het aantal zaken met betrekking tot geneesmiddeltekorten.
Afgesloten zaken
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal afgesloten zaken, inclusief variaties | 18058 | 19666 | 25071 | 28959 | 29521 |
Wetenschappelijk advies
Door wetenschappelijk advies te geven, kan het CBG bijdragen aan een verantwoorde ontwikkeling van geneesmiddelen, aan innovatie en aan early-patient access. Een wetenschappelijk advies kan gaan over alle aspecten van de productontwikkeling, zoals klinische of toxicologische, maar ook regulatoire aspecten. Het advies dient om een investeringszekerheid te verschaffen en is daarom een wettelijke taak. Er bestaan zowel nationale als centrale (Europese) procedures voor het geven van wetenschappelijk advies. Het nationale advies valt als wettelijke taak onder de directe verantwoordelijkheid van het College. Centraal wetenschappelijk advies wordt opgesteld door de SAWP en betreft een Europese consensus. Het CBG is actief in beide soorten (Europees en nationaal) wetenschappelijk advies.
Aantal toegekende wetenschappelijk adviezen in Europa
Het CBG was in 2020 weer bij een groot aantal Europese wetenschappelijke adviezen betrokken als coördinator (leidend beoordelend land). Van deze adviezen waar Nederland bij betrokken was, betroffen er 10 adviezen een COVID-19 geneesmiddel of -vaccin.
Toegewezen wetenschappelijke adviezen via SAWP
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal toegewezen wetenschappelijke adviezen via SAWP | 106 | 135 | 130 | 142 | 140 |
Nationale wetenschappelijke adviezen
Het aantal nationale wetenschappelijke adviezen in 2020 is iets gedaald ten opzichte van 2019. De instroom van nationale adviezen was vooral in het laatste kwartaal van 2020 een stuk minder dan in de jaren hiervoor. Een mogelijke oorzaak is een verschuiving van prioriteiten binnen de farmaceutische industrie door de coronapandemie. In het algemeen kan gesteld worden dat in 2020 interacties tussen ontwikkelaars en het CBG hebben geleden onder de lockdown.
Het CBG geeft ook advies op maat, waarbij startups, kleine bedrijven en academische groepen de mogelijkheid wordt geboden voor het vragen van advies tegen een gereduceerd tarief. Hiermee wordt innovatie bij universiteiten en kleine bedrijven gestimuleerd. Binnen dit advies op maat is door de coronapandemie in 2020 een speciale categorie voor COVID-19 advies ontstaan. Dit advies is bedoeld ter ondersteuning van onderzoek waarbij medicijnen en vaccins getest worden als mogelijke preventie en behandeling van COVID-19. Deze adviezen worden versneld afgehandeld en zijn kosteloos voor de aanvrager. In 2020 zijn er 3 aanvragen voor COVID-19 advies ontvangen.
Het CBG was net als in voorgaande jaren actief betrokken bij drug rediscovery-projecten van ZonMw (de Nederlandse instantie die gezondheidsonderzoek en -innovatie stimuleert en financiert). Door deze beoordelingen van projectaanvragen voor onderzoek naar geneesmiddelen die in de praktijk soms al off-label worden toegepast, draagt het CBG bij aan een mogelijke on-label toepassing door de betreffende toepassing te registreren. Hieraan zijn belangrijke voordelen verbonden voor voorschrijvers en patiënten (de geregistreerde toepassing vormt onderdeel van de productinformatie, waaronder de bijsluiter) en voor de geneesmiddelenbewaking.
Daarnaast zijn eerdere initiatieven zoals gezamenlijke wetenschappelijke adviezen met het Zorginstituut Nederland (ZIN) en de Centrale Commissie Mensgebonden Onderzoek (CCMO), ondanks problemen bij de bemensing, toch doorgegaan.
Een nieuw initiatief in 2020 betrof het betrekken van patiënten of patiëntvertegenwoordigers bij nationale wetenschappelijke adviezen. Binnen deze pilot is in 2020 bij totaal 5 wetenschappelijke adviezen een patiëntvertegenwoordiger betrokken.
Geopende zaken wetenschappelijke adviezen nationaal
| Wetenschappelijk advies | Wetenschappelijk advies op maat (incl. Covid-19 advies) | |
|---|---|---|
| 2016 | 78 | 12 |
| 2017 | 101 | 12 |
| 2018 | 110 | 6 |
| 2019 | 115 | 14 |
| 2020 | 103 | 10 |
Bijwerkingen
Het signaleren en beoordelen van bijwerkingen van een geneesmiddel, ook als het middel al is ingeschreven, is een kerntaak van het CBG. In opdracht van het CBG verzamelt, registreert en analyseert het Bijwerkingencentrum Lareb de meldingen van vermoedelijke bijwerkingen die afkomstig zijn van medische beroepsbeoefenaren en van patiënten. Relevante bevindingen uit deze analyses bespreekt het Lareb met het CBG.
In 2020 hebben het Lareb en het CBG 62 analyses van meldingen van vermoedelijke bijwerkingen besproken, waarvan er 15 zijn uitgewerkt voor bespreking in de Collegevergadering en 3 bij de Commissie Praktijk van het CBG. De overige analyses hebben hun weg gevonden in onder andere lopende procedures bij het CBG en het blijven monitoren van de meldingen.
Zoals eerder in dit hoofdstuk genoemd, is het CBG binnen Europees verband verantwoordelijk voor de signaaldetectie van 99 werkzame stoffen (of combinaties van werkzame stoffen). Daarnaast is het CBG PRAC Rapporteur voor 102 werkzame stoffen (of combinaties van werkzame stoffen). Voor deze stoffen beoordeelt het CBG alle signalen van mogelijke nieuwe of veranderde risico’s. In 2020 heeft het CBG 15 signalen beoordeeld in Europees verband.
Daarnaast draagt het CBG zorg voor de beoordeling van Periodic Safety Update Reports (PSUR) van deze werkzame stoffen, binnen de PSUR Single Assessment (PSUSA) procedure. Een PSUR, of periodieke veiligheidsrapportage, is een uitgebreide en kritische analyse van de baten-risicobalans van een product. Het geeft de geneesmiddelautoriteiten op vastgestelde tijdstippen na registratie een update over de wereldwijde ervaringen met de veiligheid van een product. Het indienen van een PSUR wordt bepaald door middel van een risicogebaseerde benadering. De frequentie waarmee PSUR's moeten worden ingediend, varieert. In 2020 heeft het CBG namens Europa 88 PSUSA‑beoordelingen uitgevoerd.
Signalen van Lareb
| Besproken in College | In commissie Praktijk | Overig | |
|---|---|---|---|
| 2018 | 11 | 3 | 36 |
| 2019 | 16 | 2 | 47 |
| 2020 | 15 | 3 | 44 |
Direct Healthcare Professional Communication
In geval van dringende en/of belangrijke veiligheidsissues worden medische beroepsbeoefenaren door middel van een brief, een zogenoemde Direct Healthcare Professional Communication (DHPC), op de hoogte gebracht. In 2020 zijn 22 DHPC’s verstuurd.
Direct Healthcare Professional Communications
| 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|
| Aantal DHPC's | 30 | 21 | 31 | 29 | 22 |
Tekorten
In 2020 heeft het Meldpunt Geneesmiddelentekorten en -defecten 3.723 meldingen van verwachte leveringsproblemen ontvangen voor in totaal 2.079 verschillende geneesmiddelen. Dat is ongeveer 6% meer dan in 2019; in dat jaar werden voor 1.965 verschillende geneesmiddelen meldingen gedaan.
Bijna de helft (48%) van de leveringsproblemen is veroorzaakt door vertraging van de productie of vrijgifte van het eindproduct. Bedrijven noemden dit in de voorgaande jaren ook al als voornaamste reden. Daarnaast speelden leveringsproblemen door een toegenomen vraag een belangrijke rol (28%). Deze toename komt veelal door een leveringsprobleem van een vergelijkbaar middel bij een of meerdere andere bedrijven.
Het Meldpunt controleert voor iedere melding of er alternatieven in Nederland beschikbaar zijn. Voor veel geneesmiddelen is dit het geval, waardoor leveringsproblemen kunnen worden opgevangen. Voor 99% van de geneesmiddelen die tijdelijk niet beschikbaar waren, was een passende oplossing beschikbaar voor de patiënt.
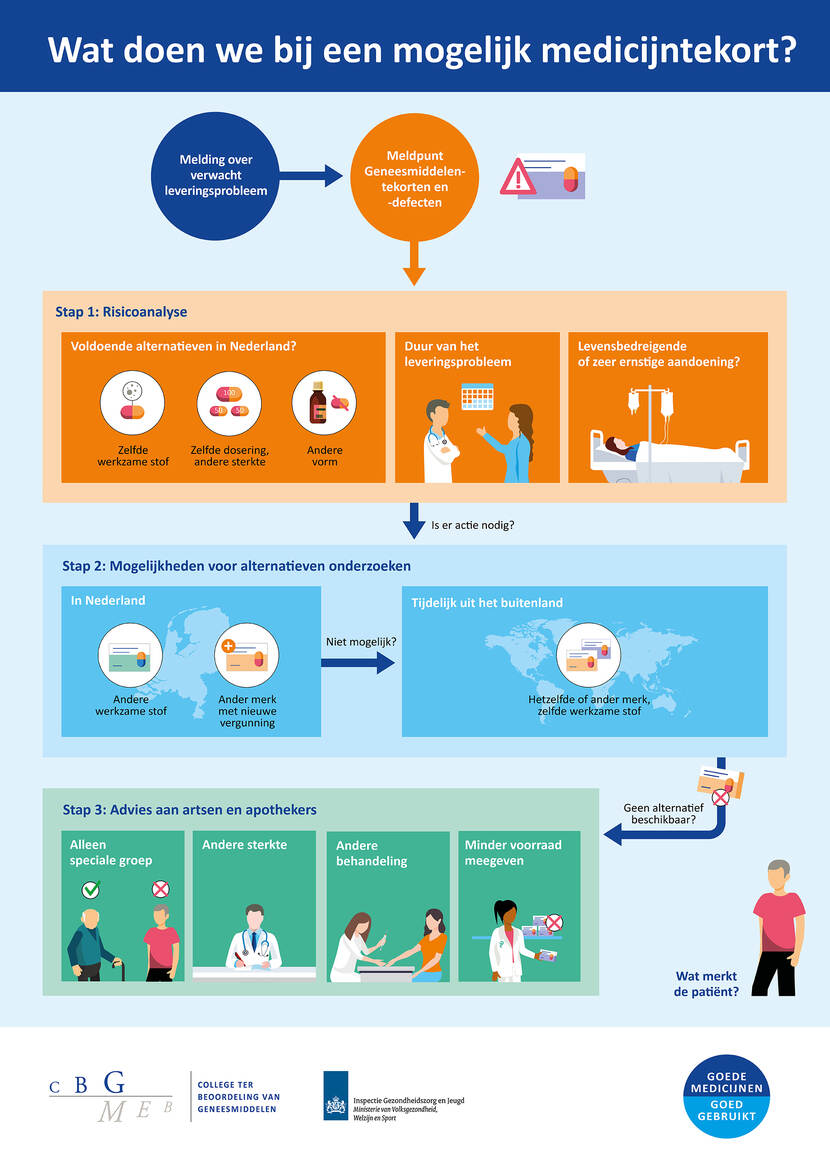
In deze infographic geven we schematisch weer welke stappen we kunnen nemen bij een mogelijk medicijntekort.
Wat doen we bij een mogelijk medicijntekort?
Melding over verwacht leveringsprobleem --> Meldpunt Geneesmiddelentekorten en -defecten -->
Stap 1: Risicoanalyse
- Voldoende alternatieven in Nederland?
- Zelfde werkzame stof
- Zelfde dosering, andere sterkte
- Andere vorm
- Duur van het leveringsprobleem
- Levensbedreigende of zeer ernstige aandoening?
Is er actie nodig? Naar stap 2.
Stap 2: Mogelijkheden voor alternatieven onderzoeken
- In Nederland
- Andere werkzame stof
- Ander merk met nieuwe vergunning
Niet mogelijk?
- Tijdelijk uit het buitenland
- Hetzelfde of ander merk, zelfde werkzame stof
Geen alternatief beschikbaar? Naar stap 3.
Stap 3: Advies aan artsen en apothekers
- Alleen speciale groep
- Andere sterkte
- Andere behandeling
- Minder voorraad meegeven
Tekorten en het coronavirus
Aan het begin van de coronapandemie ontstond onzekerheid en onrust over de gevolgen voor de beschikbaarheid van geneesmiddelen. Bijvoorbeeld als gevolg van logistieke uitdagingen en verminderde productie door lockdowns in India en China. Tevens golden in delen van de wereld gedurende een bepaalde periode exportverboden voor farmaceutische grondstoffen en eindproducten. Daarnaast werd door hamstergedrag de voorraad geneesmiddelen in openbare apotheken en drogisterijen sneller dan normaal verkocht.
Het ministerie van Volksgezondheid, Welzijn en Sport (VWS) heeft in samenwerking met de IGJ, het CBG en veldpartijen diverse (voorzorgs-)maatregelen genomen om onrust weg te nemen en tekorten te voorkomen. Zo heeft het CBG samen met veldpartijen voor een periode van 6 maanden wekelijks de voorraden en het gebruik van geneesmiddelen die een belangrijke rol spelen in de behandeling van COVID-19 gemonitord. Dankzij diverse inspanningen zijn grote beschikbaarheidsproblemen van geneesmiddelen uitgebleven. Wel worden de internationale ontwikkelingen nog altijd nauwlettend gevolgd.
*In dit hoofdstuk worden kruidengeneesmiddelen en homeopathica buiten beschouwing gelaten. Deze middelen komen in een apart hoofdstuk aan bod: Botanicals en nieuwe voedingsmiddelen.