Een farmaceutisch bedrijf kan op verschillende manieren een handelsvergunning voor een geneesmiddel aanvragen, via de nationale procedure, de decentrale procedure, of de centrale procedure. Het bedrijf mag zelf de gewenste procedure kiezen.
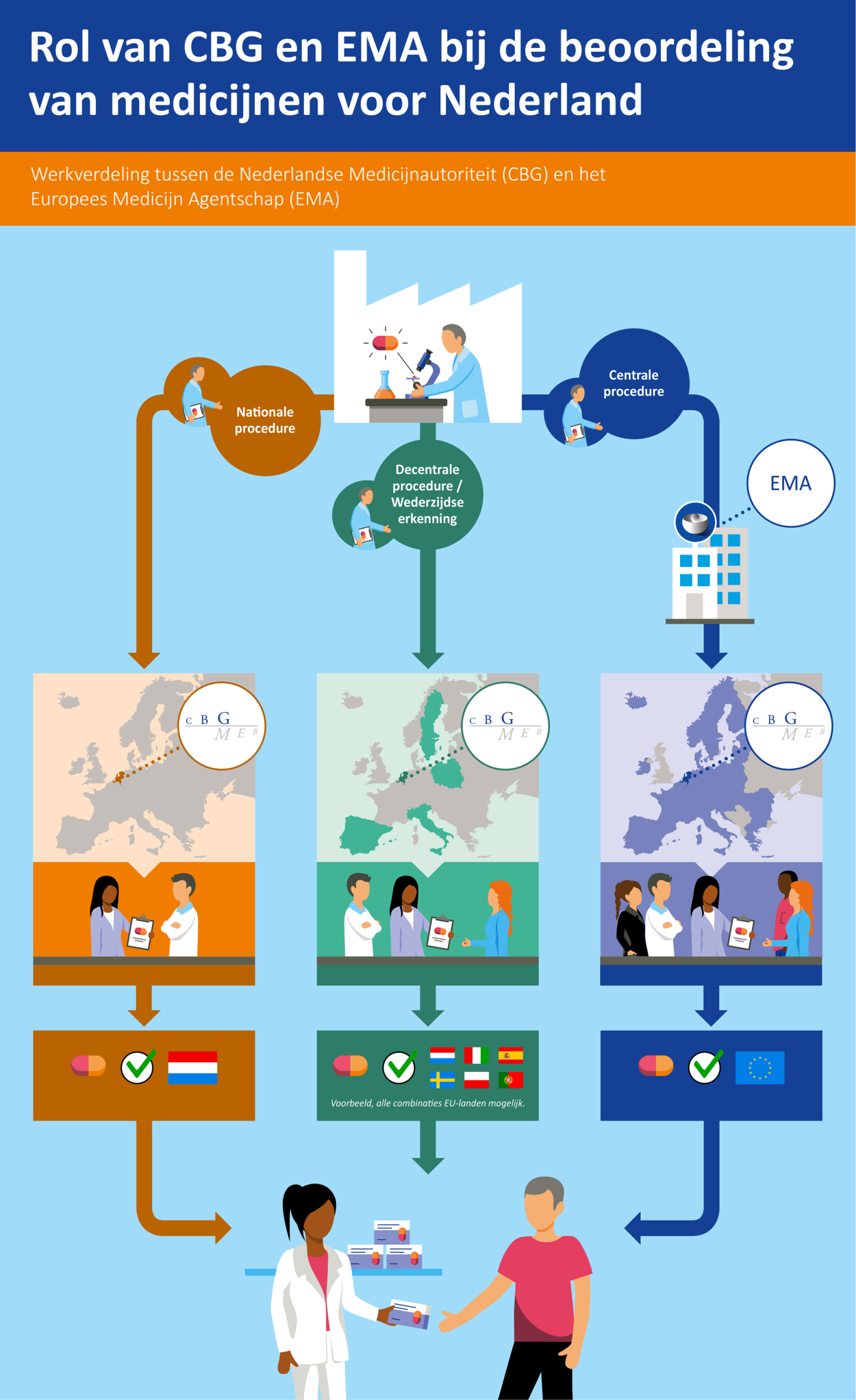
Als de nationale procedure wordt gevolgd, moet de firma een registratiedossier indienen bij het CBG of een aanvraag doen voor een parallelhandelsvergunning met verwijzing naar een Nederlands referentieproduct. In het geval van een registratiedossier zal het CBG de balans werkzaamheid / schadelijkheid beoordelen. Bij een positief oordeel verstrekt het CBG een handelsvergunning die alleen geldig is voor Nederland. Het geneesmiddel mag dan alleen in Nederland op de markt komen.
De decentrale procedure kan worden gebruikt om een handelsvergunning in meerdere lidstaten te krijgen als het bedrijf nog in geen enkel Europees land een handelsvergunning heeft gekregen. De firma vraagt één land om referentieland in de procedure te worden. De referentielidstaat leidt de beoordeling van het registratiedossier waarop de betrokken lidstaten in principe vertrouwen. In het geval van de wederzijdse erkenningsprocedure heeft het bedrijf al een handelsvergunning in een land en wenst deze uit te breiden naar andere lidstaten. Wanneer alle betrokken lidstaten een positief besluit nemen over producten in de wederzijdse erkennings- en decentrale procedure worden Nederlandse vertalingen van de SmPC, bijsluiter- en verpakkingsteksten en mock-ups ingestuurd en wordt een nationale handelsvergunning afgegeven.
Ook is er de optie om een handelsvergunning aan te vragen die in één keer geldig is voor de gehele Europese Unie. Deze route wordt de centrale procedure genoemd. Bij deze procedure wordt het registratiedossier door een farmaceutisch bedrijf ingediend bij het Europees Geneesmiddelenagentschap (EMA). Het dossier wordt beoordeeld door een rapporteur en co-rapporteur van de Committee for Medicinal Products for Human Use (CHMP), waarin alle lidstaten zijn vertegenwoordigd. Na bespreking van de rapporten die door (co)rapporteurs zijn opgesteld, wordt het eindoordeel van de CHMP naar de Europese Commissie gestuurd voor definitieve besluitvorming.
Het volgen van de centrale procedure is verplicht voor biotechnologisch bereide geneesmiddelen, en voor nieuwe geneesmiddelen die bedoeld zijn voor de behandeling van o.a. kanker, AIDS, neurodegeneratieve ziekten en diabetes. Dit is verplicht om patiënten in heel Europa direct toegang te kunnen bieden tot deze geneesmiddelen. Voor andere innovatieve producten kan een firma zelf kiezen voor het volgen van de centrale of nationale procedure.