Om een geneesmiddel of vaccin voor mensen* op de markt te mogen brengen, heeft een farmaceutisch bedrijf een handelsvergunning nodig.
Aan Nederland toegewezen (co-)rapporteurschappen via de centrale procedure (CHMP)
De CHMP is onder andere verantwoordelijk voor het beoordelen van centrale aanvragen voor handelsvergunningen van geneesmiddelen. Van de bijna 100 centrale procedures die bij de EMA binnen kwamen in 2022 trad het CBG bij een kwart van de procedures op als rapporteur of co-rapporteur. Het jaar 2022 is vergelijkbaar met 2021 afgezien van het feit dat we in 2022 vaker in de rol van co-rapporteur betrokken waren dan in 2021. Het totaal aan rapporteurschappen lijkt wat af te nemen over de jaren, de dossiers zijn echter veelal omvangrijker en meer complex.
Toegewezen (co-)rapporteurschappen
| Co-rapporteur | Rapporteur | |
|---|---|---|
| 2018 | 5 | 18 |
| 2019 | 11 | 24 |
| 2020 | 10 | 19 |
| 2021 | 2 | 21 |
| 2022 | 5 | 17 |
Toegewezen (co-)rapporteurschappen
| Land | Aantal |
|---|---|
| Oostenrijk | 16 |
| België | 2 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Tsjechië | 9 |
| Duitsland | 26 |
| Denemarken | 11 |
| Estland | 5 |
| Griekenland | 0 |
| Spanje | 13 |
| Finland | 5 |
| Frankrijk | 19 |
| Kroatië | 9 |
| Hongarije | 7 |
| Ierland | 15 |
| IJsland | 4 |
| Italië | 6 |
| Litouwen | 7 |
| Luxemburg | 0 |
| Letland | 5 |
| Malta | 1 |
| Nederland | 22 |
| Noorwegen | 7 |
| Polen | 11 |
| Portugal | 3 |
| Roemenië | 2 |
| Zweden | 21 |
| Slowaije | 8 |
| Slovenie | 4 |
In 2022 kreeg Duitsland de meeste (co-)rapporteurschappen toegewezen. Nederland volgt op een tweede plek. Daarna maken Zweden, Frankrijk en Oostenrijk de top vijf compleet. Vier landen kregen geen (co )rapporteurschappen toegewezen.
Meer Europese samenwerking
Het CBG heeft een belangrijke rol in multinationale beoordelingsteams, de zogenoemde MNAT’s (Multinational Assessment Teams). In deze teams wordt een rapporteurschap door meerdere landen opgepakt. Daardoor krijgen ook landen met minder ervaring in rapporteurschappen de kans om ervaring op te doen. Van de 22 CHMP (co)rapporteurschappen die het CBG in 2022 toegewezen kreeg, zijn er 8 als een MNAT toegewezen.
In de meeste gevallen nam het deelnemende land binnen de MNAT het beoordelen van de kwaliteitsaspecten van het geneesmiddel voor zijn rekening. De MNAT-samenwerkingsverbanden bevorderden de Europese samenwerking. Het hielp het CBG ook om de zeer hoge werklast te beheersen, in het bijzonder op het terrein van de kwaliteitsbeoordeling.
Toegewezen rapporteurschappen geneesmiddelenbewaking (PRAC)
De PRAC speelt als geneesmiddelenbewakingscomité een belangrijke rol bij het toezicht op de risico’s van geneesmiddelen voor mensen in Europa. De PRAC geeft aanbevelingen aan de CHMP en de CMDh over de risico’s van geneesmiddelen die zijn of nog worden toegelaten in de Europese Unie.
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Overige | Nieuwe stoffen | |
|---|---|---|
| 2018 | 5 | 11 |
| 2019 | 12 | 19 |
| 2020 | 9 | 11 |
| 2021 | 5 | 17 |
| 2022 | 8 | 16 |
In 2022 kreeg het CBG iets meer PRAC-rapporteurschappen toegewezen dan een jaar eerder. Van de 24 PRAC-rapporteurschappen die in 2022 aan het CBG zijn toegewezen, zijn er 16 voor nieuwe actieve stoffen. De overige rapporteurschappen gaan over generieken en biosimilars.
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Land | Aantal |
|---|---|
| Oostenrijk | 7 |
| België | 4 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Tsjechië | 2 |
| Duitsland | 17 |
| Denemarken | 9 |
| Estland | 1 |
| Griekenland | 0 |
| Spanje | 9 |
| Finland | 6 |
| Frankrijk | 4 |
| Kroatië | 5 |
| Hongarije | 0 |
| Ierland | 8 |
| IJsland | 0 |
| Italië | 4 |
| Litouwen | 5 |
| Luxemburg | 0 |
| Letland | 2 |
| Malta | 0 |
| Nederland | 24 |
| Noorwegen | 2 |
| Polen | 7 |
| Portugal | 0 |
| Roemenië | 0 |
| Zweden | 18 |
| Slovenië | 0 |
| Slowakije | 0 |
| Verenigd Koninkrijk | 0 |
Met 24 PRAC rapporteurschappen heeft het CBG een blijvende vooraanstaande rol binnen Europa. Het CBG kreeg in 2022 de meeste rapporteurschappen toegewezen. Andere hoofdrolspelers zijn Duitsland en Zweden.
Het CBG is in Europees verband ook verantwoordelijk voor de geneesmiddelbewaking van 101 werkzame stoffen. Dit betekent dat het CBG voor deze stoffen verantwoordelijk is voor het analyseren van gegevens in de Europese databank van vermoedelijke bijwerkingen (Eudravigilance databank) en voor het identificeren van signalen van mogelijke nieuwe of veranderde risico’s.
Gestarte aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
Het aantal gestarte procedures waarbij Nederland het referentieland (RMS) was, is wat lager dan in 2021.
Gestarte RMS-aanvragen via de decentrale procedure (DCP) en wederzijdse erkenningsprocedure (MRP)
| MRP | DCP | |
|---|---|---|
| 2018 | 57 | 211 |
| 2019 | 60 | 235 |
| 2020 | 85 | 174 |
| 2021 | 93 | 162 |
| 2022 | 69 | 111 |
Gestarte RMS-aanvragen via de decentrale procedure
| Land | DCP en MRP |
|---|---|
| Oostenrijk | 91 |
| België | 1 |
| Bulgarije | 0 |
| Cyprus | 2 |
| Tsjechië | 73 |
| Duitsland | 242 |
| Denemarken | 79 |
| Estland | 14 |
| Griekenland | 0 |
| Spanje | 15 |
| Finland | 38 |
| Frankrijk | 1 |
| Kroatië | 20 |
| Hongarije | 37 |
| Ierland | 30 |
| Ijsland | 55 |
| Italië | 3 |
| Litouwen | 11 |
| Letland | 17 |
| Malta | 50 |
| Nederland | 111 |
| Noorwegen | 4 |
| Polen | 39 |
| Portugal | 76 |
| Roemenië | 1 |
| Zweden | 99 |
| Slovenië | 28 |
| Slowakije | 14 |
| Verenigd Koninkrijk | 0 |
Gestarte RMS-aanvragen via de wederzijdse erkenningsprocedure
| Land | MRP |
|---|---|
| Duitsland | 51 |
| Nederland | 69 |
| Zweden | 31 |
| Oostenrijk | 16 |
| Denemarken | 15 |
| Portugal | 14 |
| Tsjechië | 10 |
| Malta | 6 |
| Ijsland | 1 |
| Hongarije | 11 |
| Finland | 8 |
| Polen | 5 |
| Ierland | 10 |
| Slovenië | 4 |
| Spanje | 12 |
| Kroatië | 2 |
| Letland | 1 |
| Slowakije | 3 |
| Estland | 2 |
| Litouwen | 4 |
| Frankrijk | 10 |
| Italië | 6 |
| Noorwegen | 4 |
| Cyprus | 3 |
| België | 2 |
| Roemenië | 0 |
| Bulgarije | 1 |
| Griekenland | 0 |
| Luxemburg | 0 |
In 2022 was Duitsland RMS voor de meeste DCP-aanvragen, gevolgd door Nederland. Nederland was RMS voor de meeste MRP-aanvragen.
Aanvragen via de nationale procedure
Het aantal ingediende aanvragen via de nationale procedure (uitgezonderd parallelimport, inclusief duplexprocedures) blijft schommelen tussen de 60 en 80 per jaar. De meeste aanvragers geven de voorkeur aan een Europese procedure (centraal en DCP), waardoor het product in meerdere Europese landen tegelijk een handelsvergunning krijgt.
Ingediende aanvragen via de nationale procedure
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| Aantal ingediende aanvragen via de nationale procedure | 57 | 67 | 87 | 59 | 80 |
Nationale aanvragen parallelimport
De stijging van het aantal aanvragen voor een parallelhandelsvergunning in 2021 heeft niet doorgezet. In 2022 zijn minder aanvragen ingediend.
Ingediende aanvragen parallelimport
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| Aantal ingediende aanvragen parallelimport | 521 | 375 | 316 | 486 | 302 |
Aantal ingeschreven handelsvergunningen
In 2022 was het totaal aantal ingeschreven handelsvergunningen in Nederland vergelijkbaar met het jaar ervoor.
Aantal ingeschreven handelsvergunningen
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| Aantal ingeschreven handelsvergunningen | 14288 | 14288 | 13565 | 13452 | 13641 |
Intrekkingen van handelsvergunning na inschrijving
Als een firma een verzoek tot intrekking van de handelsvergunning doet, bekijkt het CBG of het om een kritisch product gaat. Bijvoorbeeld of er vergelijkbare middelen in dezelfde geneesmiddelgroep zitten. Is dit niet het geval? Dan onderzoekt het CBG welke mogelijkheden er zijn om het product voor de Nederlandse patiënt te behouden. Dit doet het CBG in overleg met de vergunninghouder.
In 2022 is een lichte daling te zien van het aantal intrekkingen van handelsvergunningen.
Intrekkingen na inschrijving
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| Aantal intrekkingen | 1209 | 1390 | 1649 | 1150 | 998 |
Wetenschappelijk advies
Door het geven van wetenschappelijk advies kan het CBG bijdragen aan verantwoorde ontwikkeling van geneesmiddelen, innovatie en early patient access. Een wetenschappelijk advies kan gaan over alle aspecten. Van de productontwikkeling, zoals klinische of toxicologische, maar ook regulatoire aspecten.
Het advies helpt een investeringszekerheid te geven. Daarom is het een wettelijke taak. Er bestaan zowel nationale als centrale (Europese) procedures voor het geven van wetenschappelijk advies. Het nationale advies valt als wettelijke taak onder de directe verantwoordelijkheid van het College. Centraal wetenschappelijk advies wordt opgesteld door de SAWP en betreft een Europese consensus onder verantwoordelijkheid van de CHMP. Het CBG is actief in zowel Europees als nationaal wetenschappelijk advies. Het is overigens niet verplicht om een wetenschappelijk advies aan te vragen.
In 2022 is het CBG aangesloten bij de pilot voor simultaan nationaal advies. Dit type advies richt zich met name op de klinische studies. Aanvragers kunnen bij meerdere landen tegelijk wetenschappelijk advies aanvragen.
Toegewezen wetenschappelijke adviezen via SAWP
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| Aantal toegewezen wetenschappelijke adviezen via SAWP | 130 | 142 | 140 | 146 | 140 |
Naar aanleiding van de COVID pandemie heeft de EMA een extra categorie wetenschappelijke adviezen ingevoerd. Dit gaat via de Emergency Task Force (ETF). In 2022 heeft de ETF 48 wetenschappelijke adviezen gegeven. Hiervan heeft het CBG 7 keer als coördinator opgetreden.
Aantal nationale wetenschappelijke adviezen
Het aantal nationale wetenschappelijke adviezen is in 2022 iets gestegen vergeleken met 2021.
Geopende zaken wetenschappelijke adviezen nationaal
| Wetenschappelijk advies | Wetenschappelijk advies op maat (incl. Covid-19 advies) | |
|---|---|---|
| 2018 | 110 | 6 |
| 2019 | 115 | 14 |
| 2020 | 103 | 10 |
| 2021 | 95 | 6 |
| 2022 | 98 | 12 |
Het CBG geeft ook advies op maat waarbij startups, kleine bedrijven en academische groepen de mogelijkheid hebben om advies te vragen tegen een gereduceerd tarief. Hiermee wordt innovatie bij universiteiten en kleine bedrijven gestimuleerd. Vooral academische groepen wisten het CBG in 2022 steeds beter te vinden voor advies op maat.
Binnen dit advies op maat is door de coronapandemie een speciale categorie voor COVID-19 advies ontstaan. In 2022 is er 1 aanvraag voor COVID-19 advies ontvangen.
Het CBG was net als in voorgaande jaren actief betrokken bij drug rediscovery-projecten van ZonMw. ZonMw is de Nederlandse instantie die gezondheidsonderzoek en -innovatie stimuleert en financiert. Door de beoordeling van projectaanvragen voor onderzoek naar geneesmiddelen, die in de praktijk soms al off label worden ingezet, draagt het CBG bij aan een mogelijke on label toepassing. Hieraan zijn belangrijke voordelen verbonden voor voorschrijvers en patiënten, maar ook voor de geneesmiddelenbewaking. De geregistreerde toepassing is namelijk onderdeel van de productinformatie, waaronder de bijsluiter.
Bijwerkingen
Het signaleren en beoordelen van bijwerkingen van een geneesmiddel, ook bij een geregistreerd middel, is een kerntaak van het CBG. In opdracht van het CBG verzamelt, registreert en analyseert het Bijwerkingencentrum Lareb de meldingen van vermoedelijke bijwerkingen die afkomstig zijn van medische beroepsbeoefenaren en patiënten. Relevante bevindingen uit deze analyses stuurt het Lareb naar het CBG.
In 2022 hebben het Lareb en het CBG 63 analyses van meldingen van vermoedelijke bijwerkingen besproken. Van deze 63 analyses waren 34 COVID-19 analyses. 29 analyses hadden betrekking op andere medicijnen. Daarvan zijn 4 items niet verder geanalyseerd en werden 2 items bij het CBG als 1 item geteld. Dit verklaart het verschil met het aantal dat Lareb aanhoudt (26 in plaats van 29).
Van de 63 analyses zijn er 18 uitgewerkt voor bespreking in de Collegevergadering en 4 bij de Commissie Praktijk van het CBG. De overige analyses hebben hun weg gevonden in lopende procedures bij het CBG of worden nauwlettend gevolgd.
Signaaldetectie
Het CBG is in Europees verband verantwoordelijk voor de signaaldetectie van 101 werkzame stoffen, of combinaties van werkzame stoffen. In 2022 heeft het CBG 21 signalen beoordeeld in Europees verband.
Het CBG zorgt voor de beoordeling van Periodic Safety Update Reports (PSUR) van de 101 werkzame stoffen waarvoor CBG de signaaldetectie uitvoert, plus voor alle producten waarvoor het CBG PRAC-rapporteur is binnen de PSUR Single Assessment (PSUSA) procedure. Een PSUR, of periodieke veiligheidsrapportage, is een uitgebreide en kritische analyse van de baten-risicobalans van een product. Het geeft medicijnautoriteiten op vastgestelde tijdstippen na registratie een update over de wereldwijde ervaringen met de veiligheid van een product. Het indienen van een PSUR wordt bepaald door middel van een risico gebaseerde benadering. De frequentie waarmee PSUR's ingediend worden varieert.
In 2022 heeft het CBG namens Europa 128 PSUSA-beoordelingen uitgevoerd.
Direct Healthcare Professional Communication
In geval van dringende en/of belangrijke veiligheidsissues worden medische beroepsbeoefenaren door middel van een brief, een zogenoemde Direct Healthcare Professional Communication (DHPC), op de hoogte gebracht.
In 2022 zijn er 20 DHPC’s verstuurd. Het CBG verkent de mogelijkheden voor het digitaal verzenden van risicocommunicatie, waaronder DHPC’s en aanvullend risicominimalisatie materiaal.
Direct Healthcare Professional Communications
| 2018 | 2019 | 2020 | 2021 | 2022 | |
|---|---|---|---|---|---|
| Aantal DHPC's | 31 | 29 | 22 | 26 | 20 |
Geneesmiddelenbewaking - andere activiteiten
- Het CBG heeft, net als voorgaande jaren, samen met Lareb deelgenomen aan de Internationale Bijwerkingenweek: ‘Samen voor veilig medicijngebruik’.
- Net als voorgaande jaren heeft het CBG deelgenomen in regulatory research met een focus op farmacovigilantie. Er liepen 5 promotietrajecten in 2022. Het CBG en Lareb namen samen deel in meerdere Europese innovatie- en onderzoeksprojecten die relevant zijn voor farmacovigilantie (bijvoorbeeld Gravitate Health, UNICOM, ACCESS, Ubiquitous pharmacogenomics, IMI Conception).
- Om betrouwbare, begrijpelijke en toegankelijke informatie eenvoudig aan patiënten beschikbaar te stellen, is het Netwerk Patiënten Informatie opgericht, in samenwerking met Lareb, artsen- en apothekersverenigingen en patiëntenverenigingen. Dit netwerk is nog steeds actief. Resultaten zijn onder andere korte samenvattingen van medicijninformatie (Medicijn in het kort en Vaccin in het kort). Daarnaast is op 8 december 2022 een intentieverklaring ondertekend door 17 partijen uit het medicijninformatielandschap, waaronder BOGIN, VIG, VES, Neprofarm, CBD, KNMP en CBG en het ministerie van VWS. Deze samenwerking heeft als doel om een nieuwe, uniforme pictogrammenset te ontwikkelen. Het gebruik van uniforme pictogrammen bij medicijninformatie draagt bij aan meer begrip, beter en veiliger gebruik van medicijnen en een grotere therapietrouw.
- In 2022 heeft het CBG een samenwerkingsovereenkomst getekend met het landelijk meldpunt voor het Voorkomen van Medicatie-Incidenten (VMI). Het CBG ontvangt informatie over medicatiefouten die te maken hebben met onduidelijke, of verwarrende productinformatie of verpakkingen. Met deze informatie is het mogelijk bij te dragen aan het voorkomen van incidenten.
Geneesmiddelentekorten
De beschikbaarheid van medicijnen voor de Nederlandse markt is van groot belang voor de volksgezondheid. Het afgelopen jaar stond de beschikbaarheid van meerdere medicijnen onder druk.
Uit de jaarrapportage van het Meldpunt Geneesmiddelentekorten en -defecten blijkt dat er in 2022 meer ernstige tekorten waren dan voorgaande jaren. Ook was er vaak sprake van situaties waarin overheidsmaatregelen werden ingezet om tekorten op te vangen. Vaak was dit nodig voor een langere periode.
Het CBG besteedt de laatste jaren veel tijd aan pogingen om dreigende tekorten op te vangen. Onder andere door het zoeken naar alternatieven voor mogelijke leveringsproblemen, uit de handel halen of intrekkingen van handelsvergunningen. Het CBG beoordeelt de impact van deze meldingen op de volksgezondheid. In de meeste gevallen was er voor leveringsproblemen in 2022 nog een oplossing. Bij het beoordelen hoe kritiek het tijdelijk of definitief niet beschikbaar zijn van een medicijn is, ziet het CBG steeds vaker dat de leveringszekerheid van het zeer beperkte aantal alternatieven ook onder druk staat. Vaak zijn er maar één of twee alternatieve handelsvergunningen.
Problemen deden zich tegelijk voor en stapelden op. Zo was er een toename in meldingen van complexe problemen bij productielocaties en klinische onderzoekslocaties waarbij de beschikbaarheid van vele medicijnen getroffen werd. Daarnaast worden jaarlijks meerdere handelsvergunningen van medicijnen ingetrokken of worden medicijnen definitief uit de handel gehaald om bedrijfseconomische redenen.
Bovengenoemde ontwikkelingen leiden ertoe dat de impact van andere dreigingen op de beschikbaarheid van medicijnen in Nederland steeds groter wordt. Bijvoorbeeld de oorlog in Oekraïne: stijgende energie- en benzineprijzen zetten de beschikbaarheid van middelen in de logistieke sector onder druk. Dit heeft leveringsproblemen van medicijnen tot gevolg.
Ook in de toekomst probeert het CBG dreigende tekorten tegen te gaan. Om beschikbaarheid te waarborgen kan het CBG op nationaal niveau wijzigingen aan een registratiedossier prioriteren of versneld beoordelen, zoals het toevoegen van een nieuwe fabriek. Ook de taken voor het Meldpunt Geneesmiddelentekorten en -defecten blijven we zo goed mogelijk uitvoeren. Op Europees niveau neemt het CBG deel aan overleggen die zich richten op het verkleinen van risico’s van tekorten.
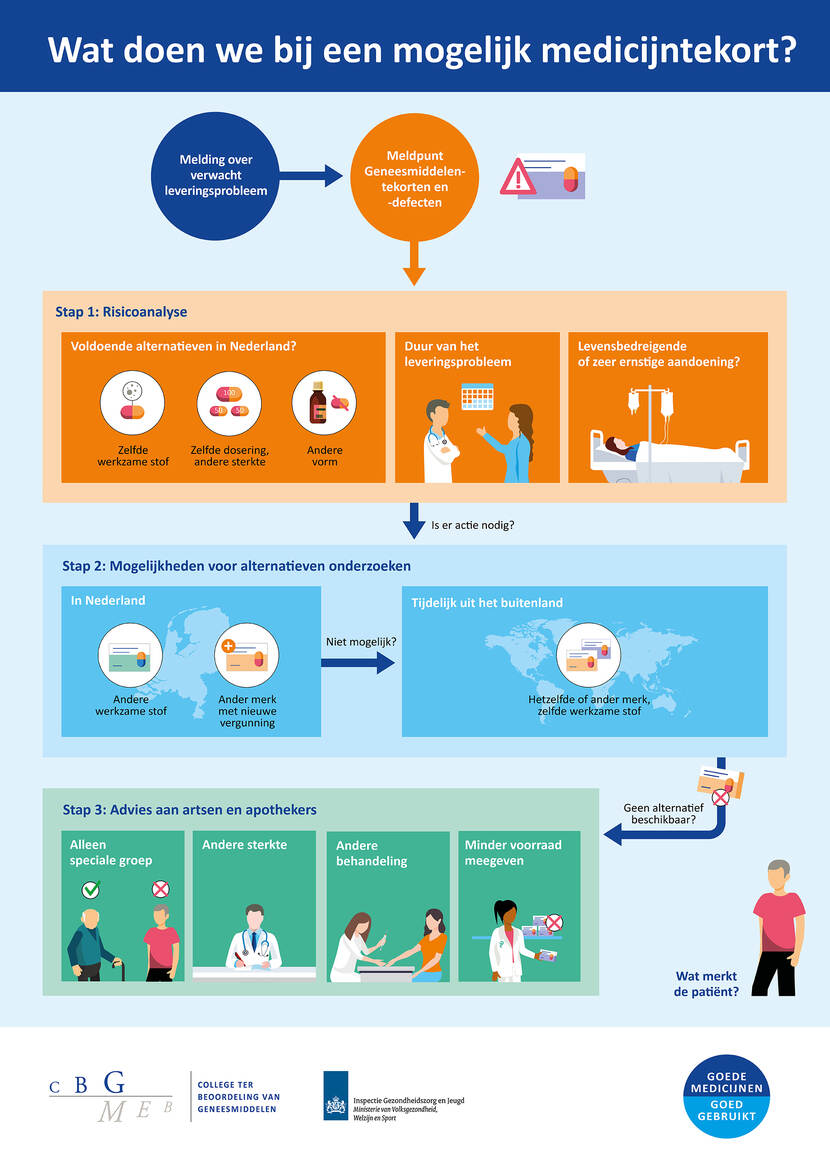
In deze infographic geven we schematisch weer welke stappen we kunnen nemen bij een mogelijk medicijntekort.
Wat doen we bij een mogelijk medicijntekort?
Melding over verwacht leveringsprobleem --> Meldpunt Geneesmiddelentekorten en -defecten -->
Stap 1: Risicoanalyse
- Voldoende alternatieven in Nederland?
- Zelfde werkzame stof
- Zelfde dosering, andere sterkte
- Andere vorm
- Duur van het leveringsprobleem
- Levensbedreigende of zeer ernstige aandoening?
Is er actie nodig? Naar stap 2.
Stap 2: Mogelijkheden voor alternatieven onderzoeken
- In Nederland
- Andere werkzame stof
- Ander merk met nieuwe vergunning
Niet mogelijk?
- Tijdelijk uit het buitenland
- Hetzelfde of ander merk, zelfde werkzame stof
Geen alternatief beschikbaar? Naar stap 3.
Stap 3: Advies aan artsen en apothekers
- Alleen speciale groep
- Andere sterkte
- Andere behandeling
- Minder voorraad meegeven
*In dit hoofdstuk worden kruidengeneesmiddelen en homeopathica buiten beschouwing gelaten. Deze middelen komen in een apart hoofdstuk aan bod: Botanicals en nieuwe voedingsmiddelen.