Om een geneesmiddel voor mensen* op de markt te mogen brengen, heeft een farmaceutisch bedrijf een handelsvergunning nodig. Het hoofdstuk ‘Procedures om een geneesmiddel op de markt te brengen’ gaat specifieker in op de verschillende routes die er zijn om een vergunning voor een geneesmiddel te verkrijgen.
Europese comités
Bij twee wetenschappelijke comités van het Europees geneesmiddelenagentschap EMA komen de lijnen samen van de beoordeling van geneesmiddelen mensen in het kader van de Europese centrale procedure: het Committee for Medicinal Products for Human Use (CHMP) en het Pharmacovigilance Risk Assessment Committee (PRAC). In deze comités zitten vertegenwoordigers van alle EU-landen. De comités komen maandelijks bijeen bij het EMA in Amsterdam.
Als Nederland rapporteur is, houdt dat in dat een team van CBG’ers de beoordeling van het dossier uitvoert. De samenstelling van het team is afhankelijk van het geneesmiddel en van de vragen die in het kader van de beoordeling moeten worden beantwoord. Vervolgens worden de uitkomsten van de beoordeling voorgelegd aan het College, waarna het College besluit met welk voorstel de Nederlandse CMHP- of PRAC-leden de bespreking in de betreffende comités ingaan.
Voor toewijzing van rapporteurschappen en co-rapporteurschappen hanteert het EMA criteria waarbij toewijzing plaatsvindt op basis van de best beschikbare expertise in de lidstaten. Hierbij is ook ruimte voor landen die in het verleden minder vaak rapporteur zijn geweest.
De toewijzing van co-rapporteurschappen is bij de PRAC anders dan bij de CHMP: het land dat CHMP-rapporteur is, wordt automatisch PRAC-co-rapporteur.
Naast de CHMP en de PRAC bestaan op het gebied van geneesmiddelen voor mensen in de centrale procedure 3 andere wetenschappelijke comités en 1 daarmee vergelijkbare werkgroep bij het EMA: het Committee for Orphan Medicinal Products (COMP), het Pediatric Committee (PDCO), het Herbal Medicinal Products Committee (HMPC) en de Scientific Advice Working Party (SAWP).
De coördinatie van het Europese werk in het kader van de decentrale en wederzijdse erkenningsprocedures is belegd bij de Coordination Group for Mutual Recognition and Decentralised Procedures human (CMDh). De CMDh is een wetenschappelijk comité van de lidstaten maar vergadert, net als de andere comités, bij het EMA en wordt ook door het EMA ondersteund.
Toegewezen (co-)rapporteurschappen
| Co-rapporteur | Rapporteur | |
|---|---|---|
| 2016 | 4 | 8 |
| 2017 | 6 | 7 |
| 2018 | 5 | 18 |
| 2019 | 11 | 24 |
Toegewezen (co-)rapporteurschappen
| Land | Aantal |
|---|---|
| Zweden | 21 |
| Nederland | 35 |
| Duitsland | 25 |
| Oostenrijk | 15 |
| Spanje | 19 |
| Denemarken | 19 |
| Frankrijk | 19 |
| Ierland | 18 |
| Polen | 16 |
| Finland | 9 |
| Tsjechië | 10 |
| Noorwegen | 7 |
| Portugal | 13 |
| Italië | 5 |
| Hongarije | 2 |
| Estland | 6 |
| IJsland | 2 |
| België | 11 |
| Letland | 4 |
| Malta | 8 |
| Kroatië | 4 |
| Roemenië | 3 |
| Griekenland | 1 |
| Litouwen | 3 |
| Slovenië | 3 |
| Slowakije | 3 |
| Verenigd Koninkrijk | 0 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Luxemburg | 1 |
Het aantal (co-)rapporteurschappen dat aan het CBG is toegewezen, is in 2019 verder gestegen. Het Verenigd Koninkrijk heeft vanwege Brexit geen (co-)rapporteurschappen meer toegewezen gekregen in 2019.
Opvallend is dat vrijwel alle aangesloten landen in 2019 één of meerdere (co-)rapporteurschappen toegewezen hebben gekregen. Het CBG vindt dit een belangrijke ontwikkeling, omdat die op den duur kan bijdragen aan een sterk en flexibel Europees netwerk.
Meer Europese samenwerking
Het CBG heeft ook een belangrijke rol in multinationale beoordelingsteams, de zogenoemde MNAT’s. In deze teams wordt een rapporteurschap gezamenlijk, door meerdere landen, opgepakt, waardoor ook landen met minder ervaring in rapporteurschappen de kans krijgen om ervaring op te doen.
Toegewezen PRAC-rapporteurschappen
De PRAC speelt als geneesmiddelenbewakingscomité een belangrijke rol bij het toezicht op de risico’s van geneesmiddelen voor mensen in Europa. De PRAC geeft aanbevelingen aan de CHMP en de CMDh over de risico’s van geneesmiddelen die zijn of worden toegelaten in de Europese Unie.
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Land | Aantal |
|---|---|
| Zweden | 16 |
| Nederland | 31 |
| Duitsland | 21 |
| Frankrijk | 7 |
| Spanje | 5 |
| Denemarken | 8 |
| Oostenrijk | 10 |
| Finland | 7 |
| Ierland | 2 |
| Polen | 8 |
| België | 6 |
| Italië | 10 |
| Noorwegen | 0 |
| Verenigd Koninkrijk | 0 |
| Hongarije | 1 |
| Letland | 1 |
| Litouwen | 0 |
| Portugal | 4 |
| Tsjechië | 5 |
| Kroatië | 3 |
| Slowakije | 2 |
| Bulgarije | 0 |
| Cyprus | 0 |
| Estland | 0 |
| Griekenland | 0 |
| IJsland | 0 |
| Luxemburg | 0 |
| Malta | 0 |
| Roemenië | 0 |
| Slovenië | 0 |
Toegewezen rapporteurschappen geneesmiddelenbewaking
| Overige | Nieuwe stoffen | |
|---|---|---|
| 2016 | 9 | 10 |
| 2017 | 0 | 14 |
| 2018 | 5 | 11 |
| 2019 | 12 | 19 |
In 2019 waren er in Europa 30% meer PRAC-rapporteurschappen dan een jaar eerder. Dat verklaart deels de stijging van het aantal rapporteurschappen voor Nederland. Van de 31 PRAC-rapporteurschappen die aan het CBG zijn toegewezen, waren er 19 voor nieuwe actieve stoffen. De overige rapporteurschappen betroffen onder andere generieken en biosimilars. Met dit aantal speelt Nederland een vooraanstaande rol binnen Europa.
Net als in 2018 valt op dat bijna één derde van het Europese netwerk niet deelneemt aan PRAC-rapporteurschappen en dat het Verenigd Koninkrijk vanwege de Brexit in 2019 is weggevallen. Verder is Nederland in Europees verband, evenals een jaar eerder, verantwoordelijk voor de geneesmiddelenbewaking van 89 werkzame stoffen. Dit betekent dat Nederland voor deze 89 stoffen verantwoordelijk is voor het analyseren van gegevens in de Europese databank van vermoedelijke bijwerkingen, de EudraVigilance-databank, en het identificeren van signalen van mogelijke nieuwe of veranderende risico's.
Gestarte aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
Nederland heeft ook in 2019 veel procedures gestart als referentieland (RMS). Het aantal procedures waar het CBG dit voor doet is de laatste jaren stabiel hoog. Het CBG geeft de firma’s de mogelijkheid in te schrijven op tijdslots waarin een aanvraag in behandeling genomen wordt. Dit zorgt ervoor dat het aantal aanvragen als referentieland gereguleerd kan worden. In Europa valt op dat Nederland en Duitsland met respectievelijk 235 en 229 gestarte decentrale procedure-aanvragen (DCP) samen bijna 44% van alle DCP-procedures leiden.
Gestarte RMS-aanvragen via de decentrale procedure (DCP) en wederzijdse erkenningsprocedure (MRP)
| MRP | DCP | |
|---|---|---|
| 2016 | 61 | 243 |
| 2017 | 70 | 230 |
| 2018 | 57 | 211 |
| 2019 | 60 | 235 |
Gestarte RMS-aanvragen via de decentrale procedure en wederzijdse erkenningsprocedure
| Land | DCP en MRP |
|---|---|
| Oostenrijk | 74 |
| België | 5 |
| Bulgarije | 0 |
| Kroatië | 15 |
| Cyprus | 0 |
| Tsjechië | 37 |
| Denemarken | 106 |
| Estland | 9 |
| Finland | 22 |
| Frankrijk | 7 |
| Duitsland | 269 |
| Griekenland | 1 |
| Hongarije | 21 |
| Ijsland | 32 |
| Ierland | 22 |
| Italië | 8 |
| Letland | 17 |
| Litouwen | 1 |
| Malta | 40 |
| Nederland | 295 |
| Noorwegen | 13 |
| Polen | 10 |
| Portugal | 136 |
| Roemenië | 1 |
| Slowakije | 7 |
| Slovenië | 4 |
| Spanje | 50 |
| Zweden | 97 |
| Verenigd Koninkrijk | 81 |
Aanvragen via de nationale procedure
Het aantal ingediende nationale aanvragen (uitgezonderd parallelimport, inclusief duplexprocedures; zie onder) fluctueert over de jaren, met in 2019 een lichte stijging ten opzichte van 2018. In veruit de meeste gevallen geven aanvragers de voorkeur voor een Europese procedure (centraal en DCP), waardoor het product in meerdere Europese landen op de markt kan komen.
Ingediende aanvragen via de nationale procedure
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal ingediende aanvragen via de nationale procedure | 46 | 66 | 57 | 67 |
Nationale aanvragen parallelimport
Na een stijging in ingediende parallelimportaanvragen in de afgelopen jaren, laat 2019 een vrij scherpe daling zien ten opzichte van deze trend. Het is lastig hiervoor een verklaring te geven, maar de invoering van de verordening vervalste geneesmiddelen (Falsified Medicines Directive, FMD) speelt mogelijk een rol. Het is immers bij parallelimport lastiger om aan de eisen voor veiligheidskenmerken te voldoen, onder andere omdat er nog een Nederlandstalige bijsluiter in het doosje gedaan moet worden.
Ingediende aanvragen parallelimport
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal ingediende aanvragen parallelimport | 428 | 445 | 521 | 375 |
Aantal ingeschreven handelsvergunningen
Na een beperkte stijging in de afgelopen jaren is het aantal in Nederland ingeschreven handelsvergunningen in 2019 vrijwel gelijk gebleven ten opzichte van 2018. Hieraan liggen twee elkaar compenserende bewegingen ten grondslag. Aan de ene kant is het aantal nieuw ingeschreven handelsvergunning gestegen. Aan de andere kant is het aantal doorgehaalde producten in 2019 hoger dan in eerdere jaren. Hier is moeilijk een eenduidige verklaring voor te geven; mogelijk spelen de invoering van de FMD en de Brexit een rol.
Aantal ingeschreven handelsvergunningen
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal ingeschreven handelsvergunningen | 14004 | 14078 | 14236 | 14239 |
Intrekkingen van handelsvergunning na inschrijving
Als een firma een verzoek tot intrekking doet van een geregistreerd medicijn, wordt gekeken of het een kritisch product betreft; bijvoorbeeld of er geen vergelijkbare middelen in dezelfde geneesmiddelgroep zitten. Als dit het geval is, onderzoekt het CBG welke mogelijkheden er zijn om het product voor de Nederlandse markt te behouden. Dit doet het CBG in overleg met de vergunninghouder.
Intrekkingen
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal intrekkingen | 1052 | 1232 | 1208 | 1385 |
Wetenschappelijk advies
Door het geven van wetenschappelijk advies kan het CBG bijdragen aan een verantwoorde ontwikkeling van geneesmiddelen, aan innovatie en aan early-patient access. Een wetenschappelijk advies kan alle aspecten van de productontwikkeling betreffen, zoals bijvoorbeeld klinisch of toxicologisch, maar ook regulatoire aspecten. Het geven van nationaal wetenschappelijk advies valt als wettelijke taak onder de directe verantwoordelijkheid van het College. Centraal wetenschappelijk advies wordt opgesteld door de SAWP en valt onder de verantwoordelijkheid van de CHMP. In het geval van een centraal Europees wetenschappelijk advies zal de beantwoording van de gestelde vragen een Europese consensus betreffen. Het CBG is actief in beide soorten (Europees en nationaal) wetenschappelijk advies.
Aantal toegekende wetenschappelijk adviezen in Europa
Het CBG was in 2019 bij meer Europese wetenschappelijke adviezen betrokken dan in voorgaande jaren. De spreiding over het Europese netwerk die een jaar eerder is ingezet, zet zich door: alle landen (met uitzondering van het Verenigd Koninkrijk) hebben in 2019 een rol gespeeld bij 1 of meerdere wetenschappelijke adviezen, terwijl in 2017 nog maar 6 landen niet actief waren.
Toegewezen wetenschappelijke adviezen via SAWP
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal toegewezen wetenschappelijke adviezen via SAWP | 106 | 135 | 130 | 142 |
Toegewezen wetenschappelijke adviezen via SAWP
| Land | 2019 |
|---|---|
| Oostenrijk | 164 |
| Duitsland | 185 |
| Denemarken | 59 |
| Verenigd Koninkrijk | 0 |
| Nederland | 142 |
| België | 144 |
| Zweden | 85 |
| Italië | 46 |
| Soanje | 46 |
| Frankrijk | 86 |
| Finland | 78 |
| Ierland | 97 |
| Portugal | 50 |
| Ijsland | 69 |
| Noorwegen | 43 |
| Kroatië | 25 |
| Polen | 36 |
| Litouwen | 21 |
| Malta | 19 |
| Letland | 1 |
| Slowakije | 3 |
Nationale wetenschappelijke adviezen
Het aantal nationale wetenschappelijk adviezen stijgt geleidelijk over de laatste jaren. Deze stijging heeft zich in 2019 doorgezet.
Het CBG geeft ook advies op maat, waarbij startups, kleine bedrijven en academische groepen de mogelijkheid wordt geboden voor het vragen van advies tegen een gereduceerd tarief. Deze vorm van wetenschappelijk advies heeft zich in 2019 verder ontwikkeld. Hiermee wordt innovatie bij universiteiten en kleine bedrijven gestimuleerd. Ook was het CBG, net als in 2018, in 2019 actief betrokken bij drug rediscovery-projecten van ZonMw (de Nederlandse instantie die gezondheidsonderzoek en -innovatie stimuleert en financiert).
Het CBG heeft in 2019 dertien keer een regulatoire toets uitgevoerd voor drug rediscovery-aanvragen bij ZonMw. Door deze beoordelingen van projectaanvragen voor onderzoek naar geneesmiddelen die in de praktijk soms al off-label worden toegepast, draagt het CBG bij aan een mogelijke on-label toepassing door de betreffende toepassing te registreren. Hieraan zijn belangrijke voordelen verbonden voor voorschrijvers en patiënten (de geregistreerde toepassing vormt onderdeel van de productinformatie, waaronder de bijsluiter) en voor de geneesmiddelenbewaking.
Hiernaast zijn in 2019 diverse eerder gestarte initiatieven voortgezet, zoals de gezamenlijke wetenschappelijke adviezen met het Zorginstituut Nederland (ZIN) en de Centrale Commissie Mensgebonden Onderzoek (CCMO).
Geopende zaken wetenschappelijke adviezen nationaal
| Wetenschappelijk advies | Wetenschappelijk advies op maat | |
|---|---|---|
| 2016 | 78 | 12 |
| 2017 | 101 | 12 |
| 2018 | 110 | 6 |
| 2019 | 115 | 14 |
Afgesloten zaken (inclusief variaties)
Het CBG handelt wekelijks honderden zaken af; van vergunningaanvragen, aanvragen voor indicatie-uitbreiding tot kleinere variaties, zoals de wijziging van een fabrikant in het dossier, het toevoegen van een bijwerking of het wijzigen van de houdbaarheid van een geneesmiddel.
Het aantal zaken dat per jaar door het CBG wordt afgehandeld, blijft groeien. Ten opzichte van 2016 heeft het CBG in 2019 60% meer zaken afgesloten en ook de stijging ten opzichte van 2018 is behoorlijk groot. Een belangrijke reden van deze stijging is de grote toename van het aantal zaken met betrekking tot tekorten. In deze zaken vindt de afhandeling plaats van ontvangen meldingen over geneesmiddeltekorten of -defecten. Ook de Brexit heeft in 2019 gezorgd voor een groter aanbod van variaties in geneesmiddelendossiers.
Afgesloten zaken
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal afgesloten zaken, inclusief variaties | 18060 | 19666 | 25071 | 28959 |
Bijwerkingen
Het signaleren en beoordelen van bijwerkingen van een geneesmiddel, ook als het middel al is ingeschreven, is een kerntaak van het CBG. In opdracht van het CBG verzamelt, registreert en analyseert het Bijwerkingencentrum Lareb de meldingen van vermoedelijke bijwerkingen die afkomstig zijn van medische beroepsbeoefenaren en van patiënten. Relevante bevindingen uit deze analyses bespreekt het Lareb met het CBG.
In 2019 hebben het Lareb en het CBG 65 analyses van meldingen van vermoedelijke bijwerkingen besproken, waarvan er 16 zijn uitgewerkt voor bespreking in de Collegevergadering en twee bij de commissie Praktijk van het CBG. De overige analyses hebben hun weg gevonden in onder andere het door het CBG zelf verwerken van de informatie in een lopende procedure en het blijven monitoren van de meldingen. In een aantal gevallen was verdere opvolging niet nodig, omdat de informatie al voldoende was verwerkt.
Signalen van Lareb
| Besproken in College | In commissie Praktijk | Overig | |
|---|---|---|---|
| 2018 | 11 | 3 | 36 |
| 2019 | 16 | 2 | 47 |
Direct Healthcare Professional Communication
In geval van urgente en/of belangrijke veiligheidsissues worden medische beroepsbeoefenaren door middel van een brief, een zogenoemde Direct Healthcare Professional Communication (DHPC), op de hoogte gebracht. In 2019 is dit 29 keer gebeurd.
Direct Healthcare Professional Communications
| 2016 | 2017 | 2018 | 2019 | |
|---|---|---|---|---|
| Aantal DHPC's | 30 | 21 | 31 | 29 |
Tekorten
In 2019 heeft het Meldpunt Geneesmiddelentekorten en -defecten 3.070 meldingen van verwachte leveringsonderbrekingen ontvangen. Dit was ruim twee keer zoveel als in 2018. Deze 3.070 meldingen gingen over 1.965 verschillende geneesmiddelen. Een derde van de meldingen ging dus over een middel waarover al eerder een melding was ontvangen. Dit komt doordat bedrijven soms meerdere keren een leveringsonderbreking voor hetzelfde geneesmiddel zagen aankomen of omdat een leveringsonderbreking langer duurde dan in de eerste melding was aangegeven.
Productieproblemen en problemen met de vrijgifte van het eindproduct zijn samen met 58% de belangrijkste oorzaken van de meldingen. Ook werd een toegenomen vraag van een geneesmiddel (21%) vaak als reden genoemd. Bedrijfseconomische redenen werden het minst als oorzaak aangedragen (1%). Een klein deel van de leveringsproblemen (8%) werd veroorzaakt door terugroepacties, vanwege vervuiling met nitrosamines, zoals bij de maagzuurremmer ranitidine.
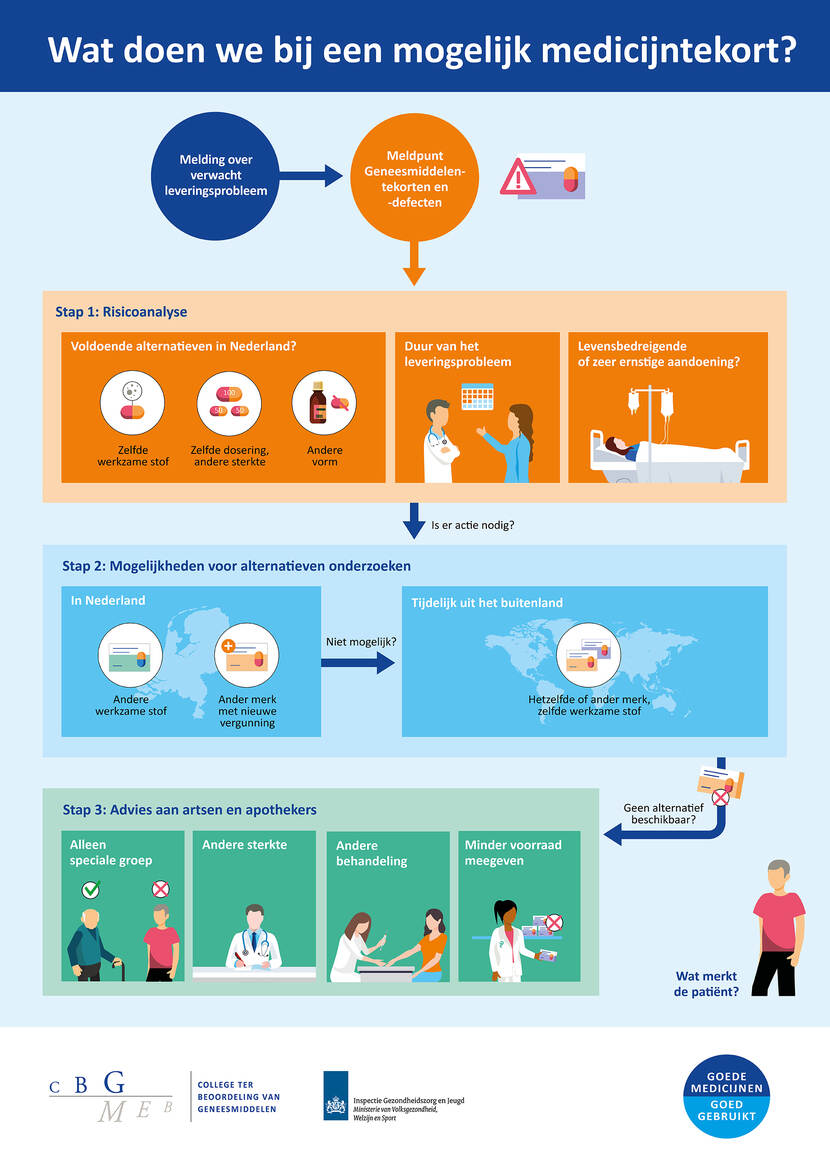
In deze infographic geven we schematisch weer welke stappen we kunnen nemen bij een mogelijk medicijntekort.
Wat doen we bij een mogelijk medicijntekort?
Melding over verwacht leveringsprobleem --> Meldpunt Geneesmiddelentekorten en -defecten -->
Stap 1: Risicoanalyse
- Voldoende alternatieven in Nederland?
- Zelfde werkzame stof
- Zelfde dosering, andere sterkte
- Andere vorm
- Duur van het leveringsprobleem
- Levensbedreigende of zeer ernstige aandoening?
Is er actie nodig? Naar stap 2.
Stap 2: Mogelijkheden voor alternatieven onderzoeken
- In Nederland
- Andere werkzame stof
- Ander merk met nieuwe vergunning
Niet mogelijk?
- Tijdelijk uit het buitenland
- Hetzelfde of ander merk, zelfde werkzame stof
Geen alternatief beschikbaar? Naar stap 3.
Stap 3: Advies aan artsen en apothekers
- Alleen speciale groep
- Andere sterkte
- Andere behandeling
- Minder voorraad meegeven
*In dit hoofdstuk worden kruidengeneesmiddelen en homeopathica buiten beschouwing gelaten. Deze middelen komen in een apart hoofdstuk aan bod: Botanicals en nieuwe voedingsmiddelen.